§ 6. Подгруппа ванадия
Члены этой подгруппы – ванадий, ниобий и тантал – похожи друг на друга так же, как Сr, Мо и W.
Ванадий довольно широко распространен в природе и составляет около 0,005% от общего числа атомов земной коры. Однако богатые месторождения его минералов встречаются весьма редко. Помимо подобных месторождений, важным источником сырья для промышленного получения ванадия являются некоторые железные руды, содержащие примеси соединений этого элемента.
Содержание ниобия (2·10–4 %) и тантала (2·10–5 %) в земной коре значительно меньше, чем ванадия. Встречаются они главным образом в виде минералов колумбита [Fe(NbO3 )2 ] и танталита [Fe(TaO3 )2 ], которые обычно смешаны друг с другом.
Технологическая переработка руд V, Nb и Та довольно сложна. Для получения свободных элементов может быть использовано взаимодействие их окислов Э2 О5 с алюминием по схеме:
ЗЭ2 О5 + 10Al = 5Аl2 О3 + 6Э
Реакция начинается при нагревании исходной смеси и протекает с большим выделением тепла.
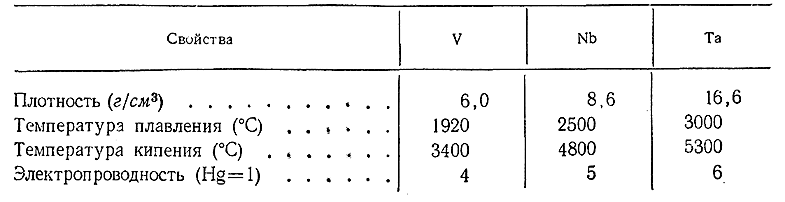
Ванадий, ниобий и тантал представляют собой не изменяющиеся на воздухе серые блестящиеметаллы, хорошо поддающиеся механической обработке. Некоторые их константы сопоставлены ниже:
В компактном состоянии все три металла весьма устойчивы по отношению к различным химическим воздействиям. Особенно характерно это для Nb и Та, которые нерастворимы во всех обычных кислотах и их смесях. Исключением является смесь HF + HNO3 , растворяющая оба металла по схеме:
ЗЭ + 5HNO3 + 21HF = 3H2 [ЭF7 ] + 5NO + 10H2 O
Ванадий растворяется только в кислотах, являющихся одновременно сильными окислителями, например, азотной:
3V + 5HNO3 = 3HVO3 + 5NO + Н2 О
Растворы щелочей на рассматриваемые металлы не действуют.
В виде порошков V, Nb и Та при нагревании соединяются с кислородом, галоидами, серой и азотом. Все три металла способны поглощать значительные количества водорода, однако определенные соединения при этом не образуются.
Наибольшее промышленное значение имеет ванадий, причем основной областью его применения является металлургия специальных сталей. Использование ниобия и тантала еще сравнительно невелико, но проявляет тенденцию к быстрому увеличению.
1) Ежегодная мировая добыча ванадия составляет около 5 тыс. т. Ванадиевая сталь широко применяется при изготовлении автомобильных и авиационных моторов, осей, рессор и т. д. Соединения ванадия потребляются главным образом в резиновой, стекольной и керамической промышленности. Они часто служат также хорошими катализаторами (преимущественно окислительных реакций).
Основным использованием ниобия является введение его в состав специальных сталей, предназначенных для изготовления сварных конструкций. Его ежегодная мировая добыча исчисляется сотнями тонн.
Чрезвычайная устойчивость тантала по отношению к различным химическим воздействиям наряду с высокой твердостью, ковкостью и тягучестью делают этот металл (а также и ниобий) особенно пригодным для изготовления различных ответственных частей заводской химической аппаратуры. Широкому развитию такого применения мешает лишь высокая цена тантала. Его ежегодная мировая выработка исчисляется десятками тонн.
Наиболее типичны для ванадия и его аналогов производные пятивалентных элементов. Кроме того, известны соединения, отвечающие валентностям IV, III и II. При переходе в ряду V–Nb–Та число таких соединений и их устойчивость уменьшаются. Все эти производные низших валентностей рассматриваемых элементов практического значения пока не имеют.
Окислы пятивалентных элементов (Э2 О5 ) образуются при накаливании мелко раздробленных металлов в токе кислорода. Из них V2 O5 имеет явно выраженный кислотный характер, а у Nb2 O5 и Ta2 O5 последний значительно ослабляется.
Красней ванадиевый ангидрид (V2 O5 ) малорастворим в воде. Его желтый раствор содержит довольно слабую вана–диевуюкислоту (HVO3 ). В щелочах V2 O5 легко растворяется, образуя соответствующие в ан а даты. Из последних практически наиболее важен сравнительно малорастворимый ванадат аммония (NH4 VO3 ), являющийся обычным продажным препаратом ванадия. Соединения этого элемента ядовиты.
2) Ванадиевый ангидрид удобно получать нагреванием NH4 VO3 на воздухе. В мелко раздробленном состоянии V2 O5 (т. пл. 675 °С) имеет оранжевый или желтый цвет. Для ванадиевой кислоты (K = 1·10–4) оба возможных направления электролитической диссоциации
VO3 – + H+ < = > VO2 OH < = > VO2 + + OH–
по вероятности протекания соизмеримы друг с другом. Хорошо растворимы в воде только вана–даты немногих одновалентных металлов.
Бесцветные Nb2 O5 и Та2 О5 тугоплавки и в воде почти нерастворимы. Отвечающие им соли – ниобаты и танталаты – могут быть получены сплавлением соответствующего ангидрида со щелочью (или окислами металлов). В водных растворах они сильно гидролизованы. При подкислении этих растворов выделяются белые студенистые осадки переменного состава Э2 O5 ·xH2 O. Обе гидроокиси растворимы не только в крепких растворах щелочей, но и в сильных кислотах, что указывает на их амфотер–ность.
3) Обезвоживание осадков гидроокисей Э2 О5 ·xН2 О ниобия и тантала нагреванием сопровождается (при потере последней гидратной воды) сильным раскаливанием массы, обусловленным значительным выделением гепла при переходе окисла из аморфного в кристаллическое состояние (теплота кристаллизации). Оба окисла плавятся лишь около 1500 °С и нелетучи. Для всех трех элементов рассматриваемой подгруппы весьма характерно образование различных перекисных соединений.
Галоидные производные пятивалентных элементов для самого ванадия не характерны (известен только VF5 ). Для Nb и Та могут быть получены все возможные пентагалогениды ЭГ5 . Они представляют собой легкоплавкие и легколетучие кристаллические вещества. Фториды и хлориды бесцветны, тогда как бромиды и иодиды имеют различные цвета от желтого до черного. Водой все пентагалогениды разлагаются с выделением осадка соответственно ниобиевой или танталовой кислоты (Э2 О5 · xH2 O). Для фторидов характерна тенденция к комплексообразованию, причем большинство производящихся от них комплексных соединений отвечает типу M2 [ЭF7 ], где М – одновалентный металл.
4) Производные низших валентностей из рассматриваемых элементов более или менее характерны лишь для ванадия Его сине–черная двуокись (VO2 ) имеет амфотерный характер. Образующиеся при ее растворении в сильных щелочах соли (ванадиты) обычно производятся от кислоты состава H2 V4 O9 (т. е. H2 O–4VO2 ), а при взаимодействии VO2 с кислотами получаются соли катиона VO2+(ванадила). Оба низших окисла ванадия – черные V2 O3 и VO – обладают лишь основными свойствами. Производные всех трех окислов и различных кислот в растворах характерно окрашены: соли VO2 – большей частью в голубой, V2 O3 – в зеленый и VO – в фиолетовый цвет. Щелочные производные VO2 имеют обычно бурую или черную окраску. Под действием окислителей (во многих случаях уже кислорода воздуха) все производные низших валентностей более или менее легко переходят в V2 O5 или соли ванадиевой кислоты.
При сопоставлении элементов подгруппы ванадия с фосфором и азотом наблюдается резкое расхождение свойств производных низших валентностей и закономерный ход'изменения характера высших окислов. Действительно, в ряду N2O5 , P2O5 , V2O5 , Nb2О3, Ta2 O5 кислотный характер окисла весьма последовательно ослабляется. Напротив, аналогичные N и Р в производных низших валентностей элементы подгруппы мышьяка уже не дают закономерного изменения химического характера высших окислов при переходе от N к Bi. Хорошей иллюстрацией изложенного может служить приводимое ниже сопоставление теплот образования окислов Э2 О5 из элементов (ккал/моль):
Sb – 230
As – 218
P – 360
N – 13
P – 360
V – 437
Nb – 463
Ta – 499


