Серы диоксид
СЕРЫ ДИОКСИД (сернистый газ, сернистый ангидрид) SO2, мол. м. 64,066; бесцв. газ с резким запахом; молекула имеет угловую форму, длина связи S—О 0,1432 нм, угол OSO 119,04°, m 0,54·10-29 Кл·м; т. пл. -75,46°С, т.кип. -10,6 °С. Для газа: плотн. 2,92655 г/л, С0р 39,8 Дж/(моль · К), 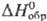 -296,81 кДж/моль,
-296,81 кДж/моль, 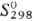 248,11 Дж/(.Дмоль·К); tкрит 157,5°С, ркрит 7,88 МПа, dкрит 0,524 г/см3. Легко сжижается в бесцв. легкоподвижную жидкость, напр. при 25 °С и давлении ок. 0,5 МПа. Для жидкого: плотн. 1,4619 г/см3 (— 10°С),
248,11 Дж/(.Дмоль·К); tкрит 157,5°С, ркрит 7,88 МПа, dкрит 0,524 г/см3. Легко сжижается в бесцв. легкоподвижную жидкость, напр. при 25 °С и давлении ок. 0,5 МПа. Для жидкого: плотн. 1,4619 г/см3 (— 10°С), 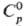 20,8 Дж/(моль·К) в интервале 273-313 К (под давлением SO2),
20,8 Дж/(моль·К) в интервале 273-313 К (под давлением SO2), 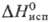 24,92 кДж/моль (263 К); давление пара над жидким SO2 0,84 МПа (50 °С), 0,325 МПа (20 °С), 0,1 (-10,06 °С); DHисп 24,90 кДж/моль (263,09 К); e 13,8. Твердый серы диоксид-бесцв. кристаллы ромбич. сингонии; ур-ние температурной зависимости давления пара над твердым SO2 lgp (мм рт. ст.) = - 1850/74 10,45 (161,6
24,92 кДж/моль (263 К); давление пара над жидким SO2 0,84 МПа (50 °С), 0,325 МПа (20 °С), 0,1 (-10,06 °С); DHисп 24,90 кДж/моль (263,09 К); e 13,8. Твердый серы диоксид-бесцв. кристаллы ромбич. сингонии; ур-ние температурной зависимости давления пара над твердым SO2 lgp (мм рт. ст.) = - 1850/74 10,45 (161,6 Т
Т 197,2 К).
197,2 К).
Серы диоксид заметно диссоциирует лишь ок. 2800 °С. Собств. диссоциация жидкого серы диоксида происходит по схеме: 2SO2 SO2+ +
SO2+ +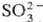 . Р-римость в воде (г в 100 г): 22,8 (О °С), 11,5 (20 °С), 2,1 (90 °С). Водный р-р SO2-сернистая к-та H2SO3: сильная двухосновная к-та (при 18°С К1 1,54·10-2, pKa1 1,81, К2 1,02·10-7, pKa2 6,91), существующая только в р-ре. Соли Н2SО3-сульфиты и гидросульфиты (см. Сульфиты неорганические). Получен гидрат клатрат-ного типа SO2·7H2O.
. Р-римость в воде (г в 100 г): 22,8 (О °С), 11,5 (20 °С), 2,1 (90 °С). Водный р-р SO2-сернистая к-та H2SO3: сильная двухосновная к-та (при 18°С К1 1,54·10-2, pKa1 1,81, К2 1,02·10-7, pKa2 6,91), существующая только в р-ре. Соли Н2SО3-сульфиты и гидросульфиты (см. Сульфиты неорганические). Получен гидрат клатрат-ного типа SO2·7H2O.
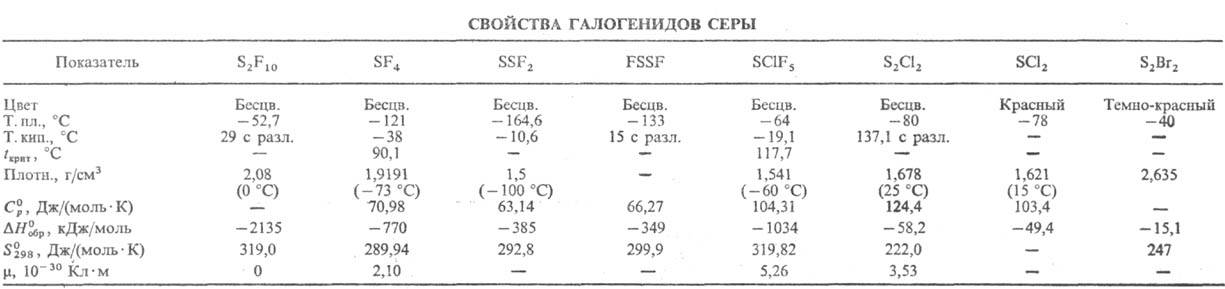
Серы диоксид раств. также в этаноле, H2SO4, олеуме, СН3СООН. Жидкий SO2 смешивается в любых соотношениях с SO3, СНСl3, CS2, диэтиловым эфиром, растворяет хлориды -РСl5, AsCl3 и мн. др., SOCl2, Вr2, I2, иодиды и роданида металлов, не раств. S. Растворенные в жидком SO2 соли диссоциируют.
Серы диоксид может восстанавливаться до S и производных S(II) и окисляться - до соед. S(VI). Сильные окислители-О3, Н2О2, HNO3, оксиды азота, р-ры хлоратов, перманганатов, хроматов окисляют SO2 до H2SO4 и ее солей. Кислород окисляет SO2 при ~ 440 °С в присут. катализатора (V2O5) до SO3; эта р-ция лежит в основе пром. способа получения SO3 и затем Н2 SO4. При высоких т-рах в присут. катализатора SO2 восстанавливается водородом до H2S, CO-до S с частичным образованием также COS, CS2. В водном р-ре, содержащем H2S и SO2 (т. наз. жидкость Вакенро-дера), происходят сложные превращения, ведущие к образованию S и политионовых к-т (см. Политионаты). С Сl2 серы диоксид дает SO2Cl2 (см. Сулъфурилгалогениды).
С газообразным NH3 серы диоксид образует амидосульфиновую HSO2NH2 и имидодисульфиновую HSO2NHSO2H к-ты, а с NH3 в присут. паров воды-(NН4)2SО3 и NH4HSO3; аналогично происходят р-ции с орг. аминами. С алканами серы диоксид в присут. О2 или Сl2 вступает в р-ции соотв. сульфо-окисления или сульфохлорирования:
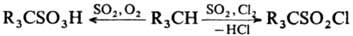
С олефинами серы диоксид образует сополимеры.
Серы диоксид получают сжиганием серы, а также как побочный продукт обжига медных и цинковых сульфидных руд. Осн. пром. способ получения SО2-из железного колчедана FeS2. Горячий обжиговый газ, полученный при сжигании FeS2 (4FeS2 + 11O2 : 2Fe2O3 + 8SO2), после отделения пыли обрабатывают слабой холодной H2SO4; при этом примеси (As2O3, SeO2 и др.) образуют туман, их отделяют в Электрофильтрах; затем серы диоксид сушат. Кроме того, серы диоксид с концентрацией до 50% по объему получают при Действии на алунит K2SO4(A12SO4)3·2A12O3 паров орг. восстановителя, содержащего непредельные углеводороды; для получения 100%-ного SO2 в этом и др. случаях в пром-сти используют поглотители-водные р-ры (NH4)2SO3-NH4HSO3. После поглощения SO2 из отходящих газов р-р нагревают до кипения, выделяющийся влажный серы диоксид охлаждают, конденсируют влагу и высушивают. В лаборатории серы диоксид получают р-цией конц. Н2 SO4 с Na2SO3 или NaHSO3 или при нагр. конц. Н2SO4 с Сu.
Осн. область применения SО2-произ-во SO3 и H2SO4. Его используют также в произ-ве сульфитов, гидросульфитов, тиосульфатов, сульфурилхлорида и др. соединений S. Серы диоксид обесцвечивает мн. орг. красители, что используется при отбеливании шерсти, шелка, соломы и т. п. Серы диоксид применяют для консервирования фруктов, ягод и как дезинфицирующее ср-во. Жидкий серы диоксид-хладагент в холодильной технике, р-ритель. Серы диоксид используют в аналит. химии, он м. б. рабочим в-вом в газовых лазерах.
Серы диоксид токсичен. При концентрации 0,03-0,05 мг/л раздражает слизистые оболочки, дыхат. органы, глаза.
ПДК в воздухе производств. помещений 10,0 мг/м3, в атм. воздухе 0,5 мг/м3. Серы диоксид-один из осн. ядов, отравляющих окружающую среду. Он вызывает образование кислотных дождей, вредно действует на живые организмы (см. Охрана природы). Содержится в дымовых газах, образующихся при сжигании сернистых тошшв, в отходящих газах переработки серосодержащего сырья, выбросах металлургич. произ-в (см. Металлургия). Об очистке пром. газов от SO2 см. Газов очистка. Хранят и транспортируют в баллонах серого цвета. и. н. один.
