Политионаты
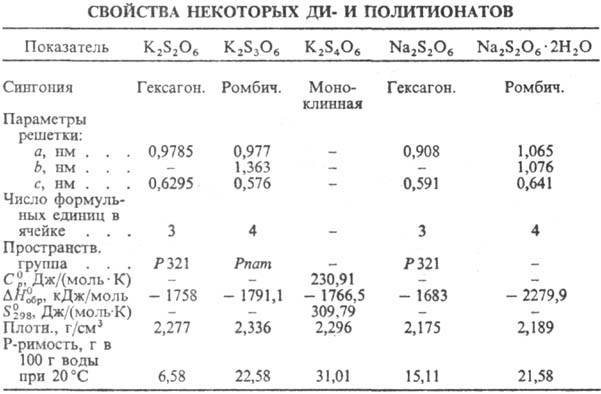
ПОЛИТИОНАТЫ, соли малоустойчивых политионовых к-т общей ф-лы HO3S—Sn—SO3H, где п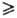 1. Содержат в структуре зигзагообразные цепи из атомов S. Известны политионаты аммония, щелочных, щел.-зем. и нек-рых др. металлов. При нагр. разлагаются; многие раств. в воде, образуют кристаллогидраты. Лучше других изучены политионаты калия и натрия-бесцв. кристаллы (см. табл.). Устойчивость политионатов падает от соед. с п = 1 к соед. с n = 4; политионаты с n > 4 малоустойчивы.
1. Содержат в структуре зигзагообразные цепи из атомов S. Известны политионаты аммония, щелочных, щел.-зем. и нек-рых др. металлов. При нагр. разлагаются; многие раств. в воде, образуют кристаллогидраты. Лучше других изучены политионаты калия и натрия-бесцв. кристаллы (см. табл.). Устойчивость политионатов падает от соед. с п = 1 к соед. с n = 4; политионаты с n > 4 малоустойчивы.
Тритионат Nа2S3О6-р-римость в воде 109,2 г в 100 г при 20 °С; образует тригидрат Na2S3O6·3H2O (А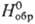 -2619,0 кДж/моль). Получают Na2S3O6 и др. три-тионаты взаимод. MI2S2O3 с SO2 либо M1HSO3 с SCl2. Тетратионат Nа2S4О6-р-римость в воде 98,8 г в 100 г при 20 °С; образует дигидрат Na2S4O6·2H2O (
-2619,0 кДж/моль). Получают Na2S3O6 и др. три-тионаты взаимод. MI2S2O3 с SO2 либо M1HSO3 с SCl2. Тетратионат Nа2S4О6-р-римость в воде 98,8 г в 100 г при 20 °С; образует дигидрат Na2S4O6·2H2O (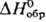 -2342,1 кДж/моль). Получают Na2S4O6 и др. тетратионаты взаимод. MI2S2O3 с 12. Пентатионаты (напр., Na,S5O6 x x 2Н2О, K2S5O6·1,5Н2О) получают взаимод. MI2S2O3 с SC12 или выделяют (наряду с MI2S4O6) из смеси политионовых к-т, образующихся при взаимод. водных р-ров H2S и SO2. Гексатионаты синтезируют взаимод. MI2S2O3 с MNO2 в соляной к-те.
-2342,1 кДж/моль). Получают Na2S4O6 и др. тетратионаты взаимод. MI2S2O3 с 12. Пентатионаты (напр., Na,S5O6 x x 2Н2О, K2S5O6·1,5Н2О) получают взаимод. MI2S2O3 с SC12 или выделяют (наряду с MI2S4O6) из смеси политионовых к-т, образующихся при взаимод. водных р-ров H2S и SO2. Гексатионаты синтезируют взаимод. MI2S2O3 с MNO2 в соляной к-те.
Формально к политионатам можно отнести дитионаты (п - 0). Дитионаты Na и К при нагр. разлагаются ок. 250 °С с образованием M2SO4 и SO2. Na2S2O6 образует гидраты с двумя, шестью (т. пл. 9,1 °С, инконгруэнтно) и восемью (т. пл. 0°С, инконгруэнтно) молекулами воды. Получают дитионаты р-цией водного р-ра MnS2O6 (образуется при взаимод. МпО2 с водным р-ром SO2) с М2СО3; кроме того, Na2S2O6 синтезируют электролизом р-ра Na2SO3.
Дитионат Na2S2O6-компонент смесей для очистки отходящих газов разл. производств; образование Na2S4O6 при взаимодействии Na2S2O3 с 12 лежит в основе иодо-метрии.
Соли несуществующей дитионистой к-ты H2S2O4 наз. дитионитами, напр. Na2S2O4 (восстановитель при кубовом крашении тканей).
Лит.: Pascal P., Nouveau traite de chimie minerale, t 2, fasc. 2, P., 1963.
И. Н. Один.
