Гей-Люссака законы
ГЕЙ-ЛЮССАКА ЗАКОНЫ: 1) объем данной массы газа при постоянном давлении изменяется пропорционально т-ре:
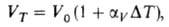
где Vo и VT-объем газа начальный и при т-ре Т;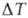 = Т — — Тo-разность этих т-р,
= Т — — Тo-разность этих т-р,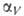 -коэф. теплового расширения газа при постоянном давлении, примерно равный для всех газов 1/273,15 К-1. Строго справедлив для идеального газа; для реальных газов выполняется тем лучше, чем дальше от критич. значений рассматриваемые т-ры и давления (см. Газы). Открыт Ж. Л. Гей-Люссаком в 1802. Вместе с Бойля-Мариотта законом и Авогадро законом послужил основанием для вывода ур-ния состояния идеального газа (см. Клапейрона-Менделеева уравнение).
-коэф. теплового расширения газа при постоянном давлении, примерно равный для всех газов 1/273,15 К-1. Строго справедлив для идеального газа; для реальных газов выполняется тем лучше, чем дальше от критич. значений рассматриваемые т-ры и давления (см. Газы). Открыт Ж. Л. Гей-Люссаком в 1802. Вместе с Бойля-Мариотта законом и Авогадро законом послужил основанием для вывода ур-ния состояния идеального газа (см. Клапейрона-Менделеева уравнение).
2)Закон объемных отношений: объемы вступающих в хим. р-цию газов и газообразных продуктов р-ции относятся как небольшие целые числа, напр. 1:1:2. Открыт Ж. Л. Гей-Люссаком в 1808.
Комментарии*
Дополнения к описанию законов Гей-Люссака:
Закон теплового расширения газов (1802):
- Коэффициент теплового расширения α = 1/273,15 К⁻¹ позволяет сформулировать закон в виде V = V₀(1 + αt), где t - температура в °C
- При температуре -273,15°C (абсолютный ноль) объем газа теоретически должен стать равным нулю
- Является основой для создания газовых термометров
Закон объемных отношений (1808):
- Пример: 2H₂ + O₂ → 2H₂O показывает соотношение объемов 2:1:2
- Этот закон сыграл ключевую роль в подтверждении атомно-молекулярной теории и определении формулы воды
- Позволил установить, что молекулы простых газов (водород, кислород, азот) двухатомны
- Закон справедлив при одинаковых температуре и давлении для всех участвующих газов
Общее значение:
- Оба закона стали экспериментальной основой для развития молекулярно-кинетической теории
- Вместе с законом Бойля-Мариотта и законом Авогадро образуют систему газовых законов
*Подобраны с помощью LLM, верифицированы, но возможны неточности.
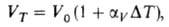
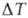 = Т — — Тo-разность этих т-р,
= Т — — Тo-разность этих т-р,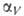 -коэф. теплового расширения газа при постоянном давлении, примерно равный для всех газов 1/273,15 К-1. Строго справедлив для идеального газа; для реальных газов выполняется тем лучше, чем дальше от критич. значений рассматриваемые т-ры и давления (см. Газы). Открыт Ж. Л. Гей-Люссаком в 1802. Вместе с Бойля-Мариотта законом и Авогадро законом послужил основанием для вывода ур-ния состояния идеального газа (см. Клапейрона-Менделеева уравнение).
-коэф. теплового расширения газа при постоянном давлении, примерно равный для всех газов 1/273,15 К-1. Строго справедлив для идеального газа; для реальных газов выполняется тем лучше, чем дальше от критич. значений рассматриваемые т-ры и давления (см. Газы). Открыт Ж. Л. Гей-Люссаком в 1802. Вместе с Бойля-Мариотта законом и Авогадро законом послужил основанием для вывода ур-ния состояния идеального газа (см. Клапейрона-Менделеева уравнение). 
Дополнения к описанию законов Гей-Люссака:
Закон теплового расширения газов (1802):
Закон объемных отношений (1808):
Общее значение: