Щелочноземельные элементы
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ: кальций Са, стронций Sr, барий Ва, радий Ra; металлы. Название сохранилось со времен алхимиков, оксиды щелочноземельных элементов по хим. св-вам напоминают оксиды щелочных металлов и "землю" - оксид Аl, входящий в состав глин. Щелочноземельные элементы имеют серебристый металлич. блеск, кристаллизуются в кубич. решетке, для Са, Sr и Ва характерен полиморфизм. На воздухе щелочноземельные элементы покрываются голубовато-серой пленкой, содержащей МО, МСО3 и отчасти МО2 и M3N2, где М - щелочноземельный элемент. Т-ры плавления Са, Sr, Ва и Ra равны соотв. 842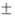 3, 768
3, 768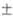 3, 727
3, 727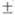 3 и 969 "С. Окисление щелочноземельных элементов на воздухе может сопровождаться воспламенением, Ва загорается уже при резке и раздавливании, поэтому щелочноземельные элементы хранят под слоем обезвоженного керосина. Все они ковки, пластичны и путем давления и резания м. б. превращены в прутки, листы, проволоку. Радий радиоактивен (Т1/2 1600 лет); подвергаясь
3 и 969 "С. Окисление щелочноземельных элементов на воздухе может сопровождаться воспламенением, Ва загорается уже при резке и раздавливании, поэтому щелочноземельные элементы хранят под слоем обезвоженного керосина. Все они ковки, пластичны и путем давления и резания м. б. превращены в прутки, листы, проволоку. Радий радиоактивен (Т1/2 1600 лет); подвергаясь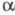 -распаду, он превращается в радон.
-распаду, он превращается в радон.
По реакц. способности щелочноземельные элементы близки к щелочным, их стандартные электродные потенциалы для полур-ции М2+ + 2е- = М равны -2,864 (Са), -2,888 (Sr), -2,905 (Ва) и -2,916 В (Ra). Поэтому все они - сильные восстановители, быстро реагируют с водой, превращаясь в М(ОН)2 с выделением Н2, а с разб. к-тами дают соли и Н2. Медленно реагируют с конц. HNO3 и H2SO4, образуя нитраты с выделением NO2 и сульфаты с выделением SO2 и Н2.
Щелочноземельные элементы раств. в жидком NH3, образуя р-ры, обладающие металлич. проводимостью. При испарении из них NH3 при низких т-рах выделяются кристаллич. комплексы [М(МН3)6]0 с металлич. блеском (похожи на бронзу), обладающие электронной проводимостью.
Щелочноземельные элементы горят в О2, давая оксиды МО, с Н2О2 образуют белые твердые пероксиды МО2, а Ва превращается в пероксид уже на воздухе при нагр. до 400 °С. Получены желтые кристаллич. надпероксиды М(О2)2. С галогенами щелочноземельные элементы дают бесцв. кристаллич. галогениды, с Н2 при натр.- бесцв., твердые, нелетучие гидриды МН2. В среде N2 при 250-450 °С превращаются в бесцв. тугоплавкие нитриды М3N2, при нагр. с В, С, Р -соотв. в черные кристаллич. бориды МВ6, бесцв. твердые ацетилениды МС2, красно-бурые фосфиды М3Р2. Стехиометрич. смеси щелочноземельных элементов с S при нагр. образуют бесцв. кристаллич. сульфиды MS. С газообразным NH3 при -10 °С или с жидким NH3 щелочноземельные элементы дают аммиакаты [M(NH3)6], в среде СО2, особенно выше 100 oС,- смесь МО и МС2. Щелочноземельные элементы образуют сплавы со мн. металлами (Al, Cu, Cd, Mg, Pb и т.д.), с Hg - амальгамы.
Растворимые в воде соли щелочноземельных элементов - ацетаты, галогениды (кроме фторидов), нитраты, тетраоксохлораты(VII), сульфиды, тиоцианаты и цианиды; нерастворимые - карбонаты, сульфаты, фосфаты, хроматы. Летучие соли щелочноземельных элементов окрашивают пламя газовой горелки в оранжево-красный (Са), карминово-красный (Sr), желтовато-зеленый (Ва) цвета.
Щелочноземельные элементы получают восстановлением оксидов алюминием в вакууме выше 1200 °С, Са - также электролизом расплава СаСl2.
Иногда к щелочноземельным элементам относят также Be и Mg.
Лит,: Степин Б. Д., Цветков А. А., Неорганическая химия, М., 1994.
Б. Д. Степин.
