Радон
РАДОН (Radon) Rn, радиоактивный хим. элемент VIII гр. периодич. системы, ат. н. 86, ат. м. 222,0176; относится к благородным газам. Природный радон состоит из смеси изотопов (a-излучатели): 222Rn (T1/2 3,8 сут), 220Rn (T1/2 55,6 с, торон Tn), 219Rn (T1/2 3,9 с), 2l8Rn (T1/2 0,035 с), являющихся членами прир. радиоактивных рядов (дочерние продукты распада изотопов Ra). Поперечное сечение захвата тепловых нейтронов для 222Rn 7,2·10-27 м2. Конфигурация внеш. электронной оболочки 6s26p6; степени окисления + 2, + 4, +6, +8; энергии ионизации Rn0 : Rn+ : Rn2+ соотв. равны 1037,07 и 2064,7 кДж/моль; атомный радиус 0,214 нм, ковалентный радиус 0,14-0,15 нм.
Радон вносит осн. вклад в естеств. радиоактивность воздуха, содержание его в атмосфере 6-10-20% по объему. Радон встречается также в гидросфере и земной коре, в осн. в газах уран- и торийсодержащих минералов. При 273 К и 0,1 МПа в равновесии с 1 г Ra находится 6,6·10-10 м3 радона.
Свойства. Радон - одноатомный газ без цвета и запаха. Т. пл. 202 К, т. кип. 211 К; плотн, жидкого 4,4 г/см3 (211 К), газа 9,81 кг/м3 (273 К, 0,1 МПа); tкрит 377,6 К, pкрит 6,24 МПа; 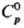 20,79 Дж/(моль·К);
20,79 Дж/(моль·К); 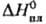 2,90 кДж/моль,
2,90 кДж/моль,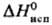 16,40 кДж/моль;
16,40 кДж/моль;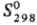 176, 12 ДжДмоль·К). Радон конденсируется в бесцв. флуоресцирующую жидкость; в газообразном и твердом состояниях светится голубым цветом. Р-римость в воде при 273 К и 0,1 МПа 4,6·10-4 м3/кг, в спиртах и орг. к-тах р-римость радона в 20-40 раз выше; хорошо раств. также в СНС13, бензоле, гексане. Парафин, каучук, жиры и особенно силикагель и активир. уголь хорошо адсорбируют радон.
176, 12 ДжДмоль·К). Радон конденсируется в бесцв. флуоресцирующую жидкость; в газообразном и твердом состояниях светится голубым цветом. Р-римость в воде при 273 К и 0,1 МПа 4,6·10-4 м3/кг, в спиртах и орг. к-тах р-римость радона в 20-40 раз выше; хорошо раств. также в СНС13, бензоле, гексане. Парафин, каучук, жиры и особенно силикагель и активир. уголь хорошо адсорбируют радон.
Радон образует соед. включения с водой и орг. соед.: Rn x x 6Н2О, Rn·3C6H5OH, Rn·2CH3C6H5 и др.; сокристалли-зуется с НС1, H2S, CO2, SO2. Радон взаимод. с F2 при 600 К, давая дифторид RnF2-бесцв. кристаллич. нелетучее в-во, по хим. св-вам подобное дифториду ксенона; RnF2 образуется также при нормальных условиях в нек-рых жидких галогенфторидах и их смесях с безводным HF. В р-циях с твердыми фторсодержащими окислителями, напр. O2SbF6, Cl2FAsF6, K2[NiF6], N2F3Sb2FM, образуются твердые нелетучие соед., содержащие катион RnF+ (RnF+TaF6- и др.). В р-рах радона в BrF5 получен фторид состава RnFn (n = 4 или 6), гидролизующийся с образованием RnO3. Хим. превращения радона сопровождаются р-циями, протекающими под действием собственного а-излучения.
Получение. Радон получают как побочный продукт в процессе переработки урансодержащих руд после перевода Ra в 1%-ные р-ры соляной или бромистоводородной к-ты. Выделяемую из р-ров смесь газов-Н2, О2, Не, Rn, CO2, Н2О, углеводородов-очищают от Н2 и О2 на нагретых до 1000 К медных сетках, от к-т и влаги-сорбцией на КОН и Р2О5, затем радон конденсируют охлаждением жидким N2 и отгонкой удаляют остаточные газы.
Определение. Качественно и количественно радон определяют ионизац. методом по энергии а-излучения и сцинтилляц. методом.
Применение. Радон используют в медицине для приготовления радоновых ванн, в с. х-ве для активации кормов домашних животных, в металлургии в качестве индикатора при определении скорости газовых потоков в доменных печах, газопроводах, в геологии при поисках радиоактивных элементов в природе и др.
Мировое произ-во радона оценивается в 10-4 м3/год.
Осн. часть радона в помещениях накапливается из строит. материалов. Предельно допустимое поступление 222Rn через органы дыхания 146 МБк/год, допустимая концентрация в воздухе 55,5 Бк/л, предел годового поступления в организм 3,6 x 108 Бк, предельная концентрация в воздухе при 40-часовой работе 1,5·105 Бк/м3.
Радон открыли в 1900 Э. Резерфорд (220Rn) и Э. Дорн и А. Дебьерн (222Rn). В 1903 Ф. Гизель и Дебьерн открыли 219Rn.
Лит.: Радиохимия и химия ядерных процессов, под ред. А. Н. Мурина, Л., 1960; Финкельштейн Д.Н., Инертны" газы, 2 изд., М., 1979; Свойства элементов, иод ред. Г. В. Самсонова, 2 изд., М., 1976; Stein L, "Radiochim. acta", 1983, v. 32. № 1/3, p. 163-71. В.Б. Соколов
