4.2. Изопроцессы идеального газа
1). Изохорный процесс (Рис.4.1).
n = Const , n 2 = n 1. (4.10)
Уравнение состояния процесса:
P2 / P1 = T2 / T1. (4.11)
Так как υ 2 = υ 1, то l = 0 и уравнение 1-го закона т/д имеет вид:
q = Du = = сv·(t2 - t1); (4.12)

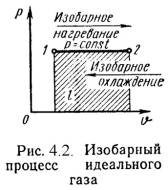
2). Изобарный процесс (Рис.4.2).
P = Const , P2 = P1
Уравнение состояния процесса:
n 2 /n 1 = T2 / T1 , (4.13)
Работа этого процесса:
l = P·(n 2 - n 1). (4.14)
Уравнение 1-го закона т/д имеет вид:
q = Du + l = ср·(t2 - t1); (4.15)
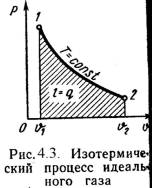
3). Изотермический процесс (Рис.4.3).
Т = Const , Т2 = Т1
Уравнение состояния:
P1 / P2 = n 2 / n 1 , (4.16)
Так как Т2 = Т1, то Du = 0 и уравнение 1-го закона т/д будет иметь вид:
q = l = R·T·ln(n 2/n 1), (4.17)
или q = l = R·T·ln(P1/P2), (4.18)
где R = Rh/ h – газовая постоянная [Дж/(кг·К)].
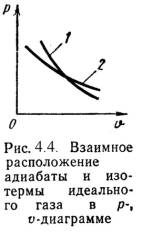
4). Адиабатный процесс (Рис.4.4).
В данном процессе не подводится и не отводится тепло, т.е. q =0.
Уравнение состояния:
P· nl = Const, (4.19)
где l = cp / cv – показатель адиабаты.
Уравнение 1-го закона т/д будет иметь вид:
l = -Du = = -сv·(t2 – t1) = сv·(t1 – t2), (4.20)
или
l = R·(T1 – T2) / (l -1); (4.21)
l = R·T1·[1 – (n 1/ n 2)l -1] /(l – 1); (4.22)
l = R·T2·[1 – (P2/P1) (l -1)/ l] /(l – 1). (4.23)