4.1.1. Образование двойного ионного слоя
В соответствии с современными представлениями остроении двойного ионного слоя (ДИС) его формирование и структура определяются электростатическим взаимодействием потенциалопределяющих и противоионов, способных до предела сжать ДИС и противоположно направленным процессом диффузии вследствие теплового движения ионов, препятствующим его сжатию. В результате этого и формируется структура ионного слоя с определенной емкостью, оказывающей влияние на многие процессы в технологии получения и переработки химических волокон, крашения и заключительной отделки текстильных материалов, получения нетканых материалов, отделки ковров и т. д.
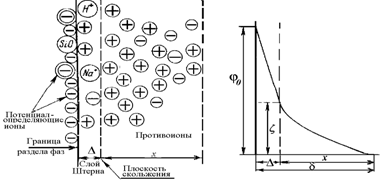
Схема строения двойного ионного слоя в соответствии с современными представлениями (на примере поверхности диоксида кремния) приведена на рис. 1.34. На этой схеме D - толщина штерновской части ДИС; x– протяженность диффузионной обкладки; d – толщина ДИС.
Можно выделить следующие основные группы ионов двойного слоя:
1. Ионы, подчиняющиеся закону Нернста
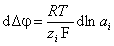 , (1.4.1)
, (1.4.1)
где F – число Фарадея, аi – активность ионов в растворе, R – универсальная газовая постоянная, T – абсолютная температура.
В соответствии с этим уравнением повышениена порядок активности (концентрации) ионов в растворе приводит кувеличениюповерхностного потенциала (разность потенциаловDj между адсорбентом и раствором) на определенную величину, при 25оС составляющую (59/zi)·10-3 В. Для этих ионов характерно адсорбционное равновесие, определяемое равенством химических потенциалов в растворе и в адсорбционном слое, т. е.
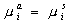 , (1.4.2)
, (1.4.2)
где индексы a и s указывают, соответственно, на адсорбированное и растворенное состояние, т.е. расположение ионов в жидкой среде.
2. Потенциалопределяющие ионы, при адсорбциистановящиеся неотличимыми от твердой матрицы. Эти ионы характерны для таких заряженных поверхностей, которые сформированы врезультате достройки кристаллической решетки и сильно связаны с поверхностью, подчас необратимо или в результате хемосорбции и способны привестик перезарядке поверхности с изменением знака поверхностного потенциала. Электрохимические потенциалы этих ионов в адсорбированном состоянии не зависят от концентрации. Они не подчиняются уравнению (1.4.1), что характерно, например, для частиц некоторых красителей.
3. Поверхностные ионы, химически связанные с поверхностью и вносящие вклад в поверхностный заряд rs. Сюда относятся хемосорбированные ионы Н+ и ОН-и характеристические группы полимерных молекул.
4. Химически не связанные с поверхностью ионы, вносящие вклад в термодинамический поверхностный избыток Гi. Это, например, молекулы ПАВ, фиксированные при физической адсорбции. Сюда также можно отнести и противоионы двойного слоя.
Рис. 1.35. Схема двойного ионного слоя на поверхности частиц кремнезоля и распределение потенциала в нем |
Образование поверхностного заряда при контакте твердого вещества с водным раствором характерно практически для всех систем, в том числе и полимерных. В некоторых случаях общий поверхностный заряд, найденный тем или иным способом, равен нулю, что соответствует точке нулевого заряда (ТНЗ). Это возможно, если количество положительных зарядов на поверхности эквивалентно количеству отрицательных, например, при наличии на поверхности заряженных групп -NH+3 и -COOH-. Поэтому, даже если электрохимические методы указывают подчас на отсутствие заряда на поверхности, она все же заряжена, что сказывается, например, на адсорбции ионных ПАВ или заряженных молекул красителя. Иное дело, если заряд поверхности нейтрализован в результате введения какого-либо ионизированного вещества.