Молярные теплоты сгорания и теплоты образования органических веществ
Измерение теплот сгорания, проводимое калориметрическим путем, дает возможность определить энергию образования органических соединений. Метод наиболее широко применяется для исследования углеводородов. Так, например, определив экспериментальным путем теплоту сгорания углеводорода СnН2n + 2 и вычтя из полученной величины значения теплот сгорания п атомов углерода (реакция С + О2 → СО2), п + 1 молекул Н2 (реакция Н2 + 1/2 О2 → Н2О) и количество энергии, необходимой для получения свободных атомов углерода и водорода (теплота сублимации алмаза и энергия диссоциации молекулы водорода), находят теплоту образования молекулы углеводорода из свободных атомов углерода и водорода. Определив эту величину для нескольких предельных углеводородов (по крайней мере для двух), можно вычислить энергию связей С—С и С—Н, считая, что она не изменяется при переходе от одного углеводорода
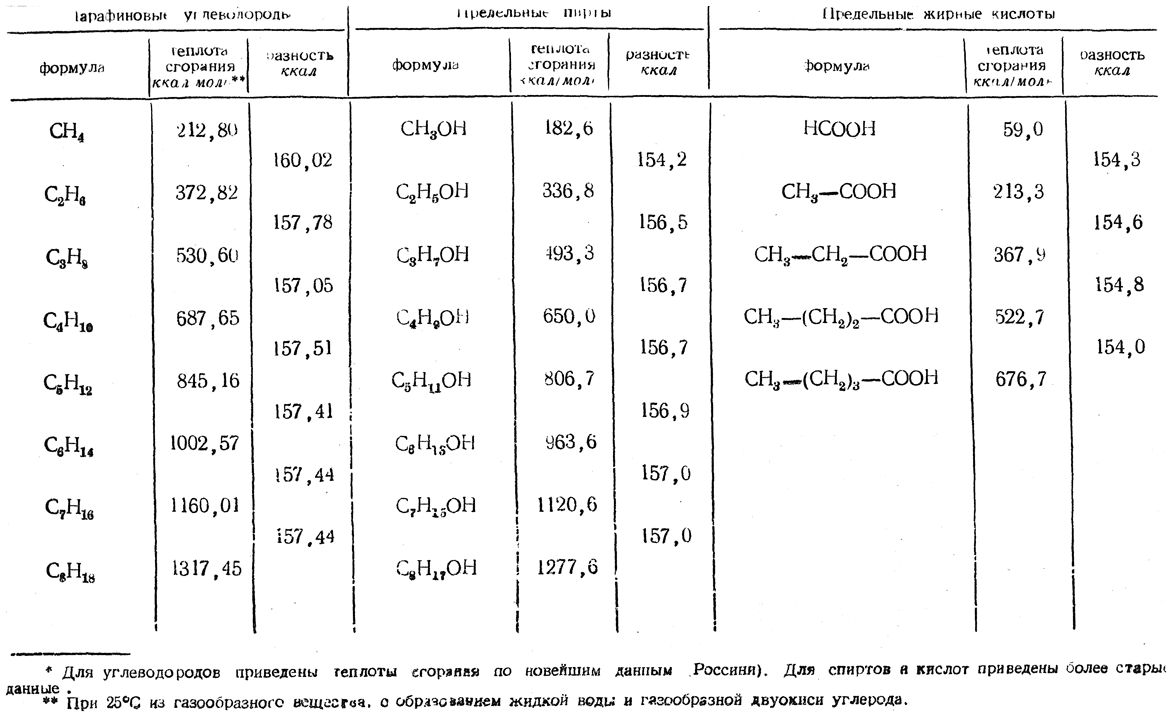
Таблица 25. Теплоты сгорания* гомологов нормального строения
к другому. Если вычислить энергию образования какого-либо другого углеводорода как сумму найденных ранее величин энергии связей С—С и С—Н, а затем определить эту энергию экспериментальным путем, получается хорошее совпадение обоих результатов. Это показывает, что энергия связей обладает свойством аддитивности. Отклонения от аддитивности, особенно часто наблюдаемые в случае молекул, содержащих сопряженные двойные связи, указывают на определенные особенности в химическом строении таких молекул. Выяснение характера этих особенностей производится путем совместного применения различных химических и физических методов исследования.
Для теплот сгорания органических веществ еще не найдено общего выражения для всех отдельных закономерностей, наблюдаемых для разных классов органических соединений, но в пределах одного гомологического ряда имеются закономерности, весьма точно подтверждающиеся результатами опытов (см., например, табл. 25 и 26).
Наиболее общая закономерность состоит в том, что разность молярных теплот сгорания для двух ближайших гомологов нормального строения, отвечающая гомологической разнице состава СН2, является величиной постоянной, в среднем равной 157,4 ккал (табл. 25).
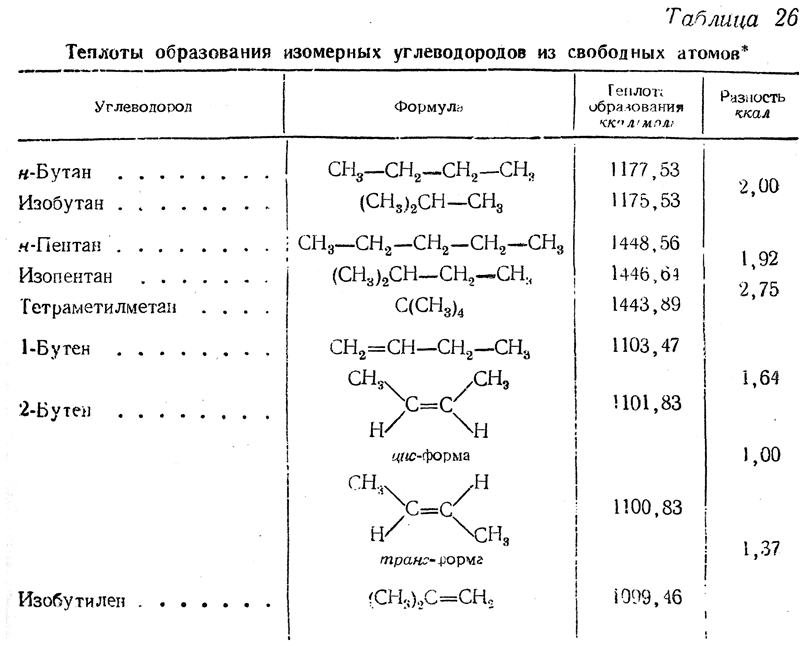
Новейшие методы позволяют определять теплоты горения с настолько большой точностью, что в настоящее время уже можно судить о разницах теплот образования многих изомерных соединений (табл. 26).
Для расчетов (конечно, приближенных) можно сделать предположение, что теплота образования сложной молекулы составляется аддитивно из теплот (или энергий) образования всех имеющихся в молекуле связей. Если, например, теплота образования метана из атомов в стандартном состоянии равна
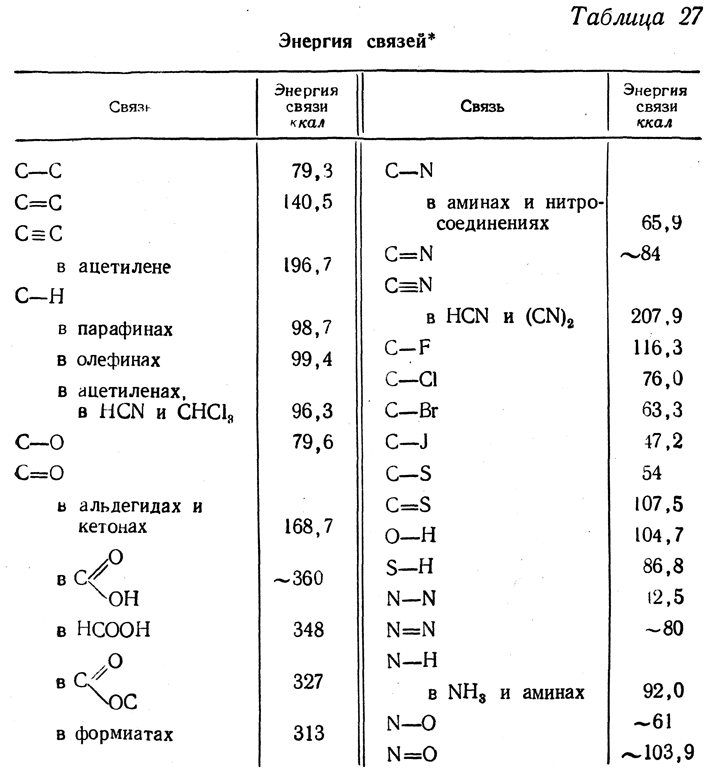
380,05 ккал/моль, средняя энергия каждой из четырех связей С—Н составит 1/4 этой величины, или 83,56 ккал. Этим путем можно подсчитать энергии ряда связей (или целых группировок связей) и, пользуясь полученными величинами, подсчитывать теплоты образования различных соединений. Расчеты теплот образования органических соединений по этим величинам дают довольно хорошие результаты, за исключением начальных членов гомологических рядов. При расчете нужно учитывать также увеличение теплот образования у более разветвленных (и более симметричных) изомеров. В табл. 27 приведены энергии различных связей.


