§ 3. Подгруппа селена
Содержание селена в земной коре составляет 1·10–50 %, теллура – 1 ·10–7%, а полония – лишь 2 ·10–15%. Последний относится к наименее распространенным в природе элементам. Он радиоактивен и с химической стороны почти не изучен.
Для селена и теллура наиболее характерно совместное нахождение с такими металлами, как Pb, Cu, Hg, Ag и Au. Однако самостоятельно минералы Se и Те встречаются крайне редко, обычно же лишь в виде примесей к аналогичным минералам серы.
Основными источниками получения селена и теллура служат отходы сернокислотного производства (пыль каналов и пылевых камер, ил промывных башен) и осадки («шламы»), образующиеся при очистке меди электролизом. Ежегодная мировая выработка селена исчисляется сотнями, теллура – десятками тонн.
1) Извлечение Se и Те из производственных отходов основано на переводе обоих элементов в четырехвалентное состояние с последующим их восстановлением сернистым газом. Восстановление первоначально ведется в 10–12 н соляной кислоте, причем выделяется только селен. Затем, после сильного разбавления жидкости водой, выделяется теллур.
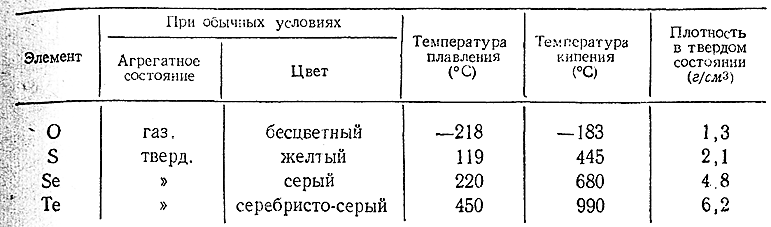
При выделении из растворов своих соединений селен и теллур осаждаются в виде порошков, соответственно красного и коричневого цвета (т. н. аморфные Se и Те). Однако наиболее типичны для них кристаллические модификации, некоторые свойства которых сопоставлены ниже со свойствами кислорода исеры. Оба элемента устойчивы на воздухе и нерастворимы в воде. Все соединения селена ядовиты.
2) Для селена и теллура известно несколько аллотропических модификаций, которые, однако, еще сравнительно мало изучены. Селен потребляется главным образом при изготовлении выпрямителей переменного тока, а теллур в производстве свинцовых кабелей. Добавка его (до 0,1%) к свинцу сильно повышает твердость и эластичность последнего Такой свинец оказывается также более стойким по отношению, к различным химическим воздействиям.
С химической стороны селен и теллур в общем весьма похожи на серу. Из металлоидов они наиболее энергично взаимодействуют с фтором и хлором, а с кислородом (как и сера) соединяются лишь после предварительного нагревания. С газообразным водородом частично реагирует при повышен ных температурах только селен, тогда как теллур с ним непосредственно не соединяется. Со многими металлами Se и Те дают при нагревании аналогичные сульфидам селениды и теллурриды (например, K2 Se, K2 Te).
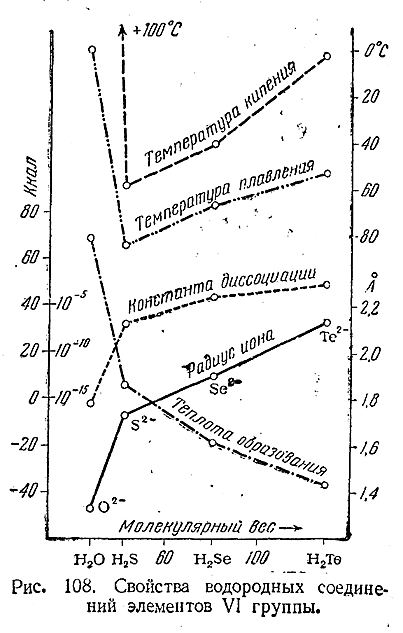
При действии на них разбавленных кислот образуются селено–водород (H2 Se) и теллуроводород (Н2 Те). Оба они представляют собой бесцветные газы с характерными неприятными запахами. Растворимость их в воде примерно такая же, как у сероводорода, причем растворы показывают ясно выраженную кислую реакцию. Некоторые важнейшие свойства рассматриваемых соединений сопоставлены в приводимой таблице и на рис. 108 с аналогичными свойствами Н2 О и H2 S. Для приблизительной ориентировки в размерах соответствующих молекул приведены также радиусы ионов Э2–.

Из данных таблицы видно, что H2 Se и Н2 Те являются кислотами более сильными, чем уксусная (К = 2· 10–5). Оба соединения (особенно Н2 Те) весьма неустойчивы и легко разлагаются. Кислородом воздуха они постепенно окисляются и в газообразном состоянии и особенно в растворе уже при обычных температурах. В общем восстановительные свойства характерны для H2 Se и Н2 Те еще более, чем для сероводорода.
3) Все галоидные соединения селена и теллура могут быть получены путем взаимодействия элементов. Известны следующие галогениды:

По своему характеру галогениды селена похожи на соответствующие производные серы, причем тип Э2 Г2 в данном случае менее, а тип ЭГ4 – более устойчив.
Галогениды теллура уже резко отклоняются по свойствам от производных серы. Так, TeF6 довольно легко разлагается водой, a TeJ4 образуется при совместном растирании элементов в присутствии воды (тогда как иодиды селена и серы вообще не получены).
При нагревании в токе воздуха селен и теллур сгорают с образованием двуокисей. Последние представляют собой бесцветные кристаллические вещества, сильно отличающиеся друг от друга по растворимости в воде: у SeO2 она весьма велика, у TeO2 очень мала.
Подобно SO2 , двуокиси селена и теллура являются кислотными ангидридами: при растворении их в воде образуются соответственно селенистая (H2 SeO3 ) и теллуристая (Н2 ТеО3 ) кислоты. Обе они диссоциированы несколько слабее сернистой.
Соли селенистой кислоты (селенистокислые, или селениты) могут быть получены нейтрализацией растворов H2 SeO3 , соли теллуристой (теллуристокиелые, или теллуриты) –растворением ТеО2 в щелочах. И те и другие, как правило, сходны по свойствам с соответствующими сульфитами.
В то время как для четырехвалентной серы восстановительные свойства характернее окислительных, для SeIVи TeIVимеет место обратное: они довольно легко восстанавливаются до элементарных Se и Те, например, по схеме:
Н2 ЭО3 + 2SO2 + Н2 О = 2H2 SO4 + Э
Напротив, селен и теллур переходят в шестивалентное состояние лишь под действием наиболее сильных окислителей.
4) Селенистая кислота (K1 = 2·10–3, K2 = 5·10–9) может быть получена по реакции: 3Se + 4HNO3 + H2 O = 3H2 SeO3 + 4NO. Ее окислительные свойства выражены не особенно сильно. Так, она окисляет J’, но не способна окислить Вr. Из солей Н2 SеО3 следует отметить малорастворимый селенит серебра – Ag2 SeO3 .
Теллуристая кислота (K1 = 2·10–3, K2 = 1·10–8) не была выделена з индивидуальном состоянии. Ее окислительные свойства выражены слабее, чем у селенистой. Так, SO2 ею окисляется, но J' не окисляется. Амфотерность теллуристой кислоты проявляется при растворении ТеО2 в концентрированных сильных кислотах – происходит образование солей четырехвалентного теллура (например, TeO2 + 4HJ < = > TeJ4 + 2H2 O).
При окислении H2 SeO3 и H2 TeO3 , например, по схеме
5Н2 ЭО3 + 2НСlО3 = 5Н2 ЭО4 + Сl2 + Н2 О
образуются соответственно селеновая (H2 SeO4 ) или теллуровая (Н2 Те04 ) кислота. Обе они представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде. Селеновая кислота по силе приблизительно равна серной, тогда как теллуровая является кислотой весьма слабой.
Соли селеновой кислоты (селеновокислые, или селена–ты) по свойствам похожи на соответствующие сульфаты. Напротив, соли теллуровой кислоты (теллуровокислые, или теллур а ты) существенно отличаются от них. Например, BaТеО4 выделяется из раствора с кристаллизационной водой и легко растворяется в соляной кислоте. В воде хорошо растворимы лишь теллураты наиболее активных одновалентных металлов.
Обе рассматриваемые кислоты являются сильными окислителями, например с НСl взаимодействуют по схеме:
Н2 ЭО4 + 2НСl < = > Н2 ЭО3 + Сl2 + Н2 О
В кислой среде равновесие смещается вправо, в щелочной влево.
5) Свободная селеновая кислота (К2 = 1·10–2) проще всего получается обработкой взвеси Ag2 Se03 бромной водой. Реакция идет по уравнению: Ag2 Se03 + Br2 + H2 O = 2AgBr + H2 SeO4 . Теллуровая кислота (К1 = 2·10–8, K2 = 5·10–11) может быть получена взаимодействием аморфного теллура с Н2 О2 . Выделяемся она в виде бесцветного кристаллогидрата Н2 Те04 • 2Н2 O. Как и у йодной кислоты (VII § 4 доп. 6), водороды входящей в состав этого кристаллогидрата воды способны замещаться на металл. Например, известны соли состава Ag6 TeO6 и Hg3 TeO6 , отвечающие шестиосновной ортогеллуровой кислоте– Н6 ТеO6 .
При нагревании Н2 Те04 до 300 °С отщепляется вода и остается желтый порошок трехокиси теллура (ТеО3 ). Дальнейшее нагревание ведет к распаду этого окисла на ТеО2 и кислород. Трехокись теллура практически нерастворима ни в воде, ни в разбавленных кислотах и щелочах. Однако крепкие растворы щелочей растворяют ее с образованием соответствующих теллуратов.
Получить трехокись селена (SeO3 ) долго не удавалось. Она была получена (взаимодействием K2 SeO4 с избытком SO3 ) лишь недавно и представляет собой бесцветные кристаллы (т. пл. 118°С), хорошо растворимые в воде с образованием селеновой кислоты.