4.2.4. Влияние электролитов на электрокинетический потенциал
В соответствии с приведенным ранее уравнением теории строения двойного ионного слоя Гуи-Чепмена, электрокинетический потенциал должен уменьшаться линейно при повышении концентрации электролита, пропорционально C1/2. Такая зависимость может проявляться только в случае, если наблюдается лишь электростатическое взаимодействие, т.е. происходит неспецифическая адсорбция введенных в систему ионов. Поскольку именно такие представления положены в основу теории Гуи-Чепмена, хотелось бы напомнить, что неспецифическая адсорбция является лишь идеализацией, хотя в целом и полезной, реальной ситуации.
На практике зависимость электрокинетического потенциала от концентрации электролитов определяется прежде всего именно специфической адсорбцией ионов, что приводит к тому, что ионы одинаковой валентности будут тем сильнее снижать электрокинетический потенциал, чем меньше их гидратная оболочка, что способствует адсорбции. Например, на одинаково заряженной отрицательной поверхности можно наблюдать такой ряд адсорбции: 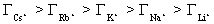 .
.
Лиотропный ряд снижения электрокинетического потенциала будет противоположен ряду адсорбции (чем выше адсорбция, тем ниже z-потенциал). Поскольку противоионы тем больше будут способны накапливаться в слое Штерна и экранировать потенциал определяющие ионы, чем меньше их размер в гидратированном состоянии, то именно в такой последовательности будет уменьшаться число ионов в диффузионной части двойного слоя, снижаться электрокинетический потенциал и устойчивость дисперсных систем. Естественно, что двухзарядные ионы будут более эффективны, чем однозарядные, так как у них не только выше электростатическое взаимодействие с потенциалопределяющими ионами, но и значительно сильнее проявляется специфическая адсорбция, приводящая к повышению степени заполнения слоя Штерна. При низких концентрациях электролитов это способно вызывать рост поверхностной проводимости, неучет которой приводит к появлению кажущейся экстремальной зависимости электрокинетического потенциала от концентрации электролитов, найденной из измерений электрофоретической подвижности частиц или электроосмотической скорости дисперсионной среды. Критерием, который показывает необходимость учета поверхностной проводимости электрокинетического потенциала по данным электрофореза, служит отношение поверхностной и объемной проводимостей:
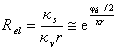 , (1.4.39)
, (1.4.39)
где ks, kv – удельная поверхностная и объемная проводимость; k- параметр Дебая; r – радиус капилляра или частицы. Если Rel<<1, то электрофорез (и электроосмос) не осложнен поверхностной проводимостью и нечувствителен к форме частиц (или капилляров). Максимум на зависимостях z-потенциала от концентрации электролита свидетельствует об изменении режима электрофоретической подвижности (электроосмотической скорости) от Rel.
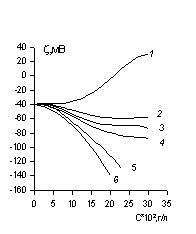 |
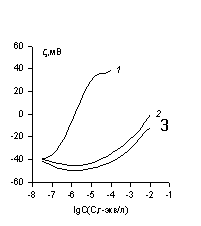
Пример зависимости электрокинетического потенциала капрона от концентрации некоторых ПАВ по данным [7] приведен на рис. 1.43. Влияние поливалентных электролитов на электрокинетический потенциал золя красителя было показано на рис. 1.37. На рис. 1.44 приведена зависимость электрокинетического потенциала волокна капрон от концентрации некоторых электролитов.
Риc. 1.44. Зависимоcть z-потенциала волокна капрон от концентрации электролитов. Электролиты: 1 – AlCl3; 2 –Na2SO4; 3 – NaCl |
Зависимость z-потенциала волокна от концентрации поливалентного электролита, например, от AlCl3 (см. рис. 1.44.), характеризуется изоэлектрической точкой и последующей перезарядкой. Это связано с тем, что ион имеет высокий специфический адсорбционный потенциал, вследствие чего способен адсорбироваться на поверхности волокна в сверхэквивалентном количестве. Катионактивные ПАВ проявляют свою адсорбционную активность в том, что изоэлектрическая точка зависит не только от величины заряда поверхности, но и от гидрофобности волокна. Чем более гидрофобно волокно, тем ниже концентрация ПАВ, при которой достигается изоэлектрическая точка, хотя z-потенциал волокна в водной среде у этих волокон выше.
Следует отметить, что определение заряда поверхности (числа отрицательно заряженных групп, например, карбоксильных) по равновесной адсорбции катионактивных веществ нельзя считать корректным. Это связано с тем, что адсорбция катионактивного вещества происходит не только в результате взаимодействия заряженной полярной группы ПАВ с отрицательными поверхностными потенциалопределяющими ионами волокна, но и вследствие ван-дер-ваальсова взаимодействия углеводородных радикалов ПАВ с гидрофобными участками волокна. Именно такого рода взаимодействие, усиливающееся с ростом длины углеводородного радикала, приводит к адсорбции анионактивных веществ на гидрофобных участках поверхности волокна капрон, увеличивающей отрицательный z-потенциал, что видно из данных, приведенных на рис. 1.43. Отметим, что незаряженные молекулы неионогенных ПАВ способны снижать электрокинетический потенциал волокон, что объясняется обычно смещением плоскости скольжения на более далекие расстояния от поверхности в результате образования структурированного адсорбционного слоя оксиэтилированных неионогенных веществ.
Влияние электролитов на электрокинетический потенциал частиц полимера в латексах не только связан с изменением структуры двойного ионного слоя, но и в значительной мере определяется изменением адсорбции ионов ПАВ. Детально ознакомиться с проявлением различных эффектов при добавлении электролитов в латексы можно в книге Р.Э. Неймана [5].