Бария хлорид
БАРИЯ ХЛОРИД ВаС12, бесцв. кристаллы. До 925°С устойчива а-модификация с ромбич. решеткой (а = = 0,7823 нм, b = 0,9333 нм, с = 0,4705 нм, пространств. группа Рпта), при 925-961 °С -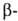 модификация с кубич. решеткой (пространств, группа Fm3m);
модификация с кубич. решеткой (пространств, группа Fm3m);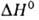 перехода
перехода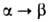 17,36 кДж/моль. Т. пл. 961 °С, т. кип. 2047°С; плотн. 3,856 г/см3; Cop 75,14 Дж/(моль*К);
17,36 кДж/моль. Т. пл. 961 °С, т. кип. 2047°С; плотн. 3,856 г/см3; Cop 75,14 Дж/(моль*К);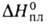 15,9 кДж/моль,
15,9 кДж/моль,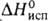 241,4 кДж/моль,
241,4 кДж/моль,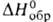 -844,0 кДж/моль,
-844,0 кДж/моль,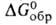 -795,8 кДж/моль; 5^8 123,7 Дж/(моль*К). Диамагнитен. Р-римость в воде (г в 100 г): 31,7 (0°С), 36,2 (20°С), 58,7 (100°С). Немного раств. в спирте, не раств. в эфире. С А1С13, LiCl, NaCl, BaSO4, ВаТiO3, BaWO4 образует эвтектич. смеси, с ВаВг - непрерывный ряд твердых р-ров, с нек-рыми солями -соединения, напр. СаС12*ВаС12, 2КС1*ВаС12, 2CsCl*BaCl2. Из водных р-ров кристаллизуется ди-гидрат-бесцв. кристаллы с моноклинной решеткой (а = = 0,7136 нм, b = 0,1086 нм, с = 0,6738 нм,
-795,8 кДж/моль; 5^8 123,7 Дж/(моль*К). Диамагнитен. Р-римость в воде (г в 100 г): 31,7 (0°С), 36,2 (20°С), 58,7 (100°С). Немного раств. в спирте, не раств. в эфире. С А1С13, LiCl, NaCl, BaSO4, ВаТiO3, BaWO4 образует эвтектич. смеси, с ВаВг - непрерывный ряд твердых р-ров, с нек-рыми солями -соединения, напр. СаС12*ВаС12, 2КС1*ВаС12, 2CsCl*BaCl2. Из водных р-ров кристаллизуется ди-гидрат-бесцв. кристаллы с моноклинной решеткой (а = = 0,7136 нм, b = 0,1086 нм, с = 0,6738 нм,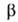 =91,08°, z = 4, пространств. группа Р21/п); плотн. 3,097 г/см3;
=91,08°, z = 4, пространств. группа Р21/п); плотн. 3,097 г/см3;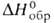 — 1446,4 кДж/моль; при 100°С обезвоживается. Известен также моногидрат - бесцв. кристаллы с ромбич. решеткой (пространств, группа Ртсп).
— 1446,4 кДж/моль; при 100°С обезвоживается. Известен также моногидрат - бесцв. кристаллы с ромбич. решеткой (пространств, группа Ртсп).
Получают бария хлорид: прокаливанием смеси баритового концентрата с коксом и СаС12 при 900-1000°С (BaSO4 + 4С + СаС12 -> ВаС12 + CaS + 4CO); взаимод. BaS с соляной к-той, р-ром NaCl в соляной к-те, водными р-рами MgCl2, NH4C1, C12; p-цией ВаС2, ВаСО3, Ва(ОН)2 или Ва(ООССН3)2 с соляной к-той. Бария хлорид - применяют в произ-ве пигментов (напр., баритового желтого ВаСrО4, касселевой зелени ВаМnО4), др. соед. Ва, в кач-ве добавки в электролиты при получении Mg, для закалки быстрорежущей стали (в виде расплавов смеси ВаС12 с хлоридами щелочных и щел.-зем. металлов), как компонент керамики, реактив на ион SO42-, для утяжеления и осветления кожи в кожевенной пром-сти, как зооцид. Бария хлорид токсичен; ПДК 0,5 мг/м3.
Лит. см. при статьях Барий, Бария гидроксид. Т. Г. Ахштов.
