§ 4. Фосфор
Фосфор относится к весьма распространенным элементам – на его долю приходится около 0,04% от общего числа атомов земной коры. Он имеет исключительное значение для жизни, так как входит в состав некоторых белковых веществ (в частности, нервной и мозговой тканей), а также костей и зубов. Скопления фосфора встречаются главным образом в виде минерала апатита [Са5 Х(РО4 )3 , где X = F, реже Сl или ОН] и залежей фосфоритов, состоящих из Са3 (РО4 )2 с различными примесями.
Свободный фосфор получают из природного фосфорнокислого кальция накаливанием его с песком (SiO2 ) и углем в электрической печи. Процесс протекает по суммарному уравнению:
Са3 (РО4 )2 + 3SiO2 + 5С = 3CaSiO3 + 5СО + 2Р
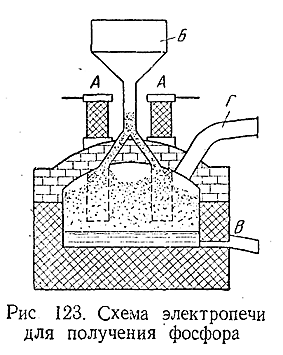
Схема электропечи для получения фосфора показана на рис. 123 (А – массивные угольные электроды, Б – загрузка смеси фосфата с песком и углем, В – вывод жидкого шлака, Г – выход паров фосфора). Образующиеся пары фосфора отводят в орошаемые водой конденсаторы и затем собирают в приемнике с водой, под слоем которой расплавленный фосфор и накапливается.
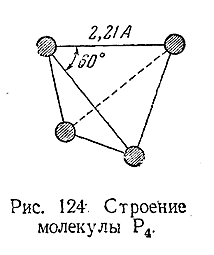
В парах (ниже 800°С) и в жидком состоянии фосфор четырехатомен, причем молекула Р4 имеет структуру правильного тетраэдра (рис. 124). Для твердого фосфора известно несколько аллотропических модификаций, из которых практически приходится встречаться с двумя – белой и красной.
В результате охлаждения паров фосфора получается белая форма. Она характеризуется плотностью 1,8, т. пл. 44°С и т. кип. 281 °С. В воде белый фосфор практически нерастворим, но хорошо растворяется в сероуглероде (CS2). Хранят его под водой и по возможности в темноте.
При хранении белого фосфора он постепенно (очень медленно) переходит в более устойчивую красную форму. Переход сопровождается выделением тепла (теплота перехода):
Pбелый = Pкрасный + 4 ккал
Процесс ускоряется при нагревании и под действием света. Практически красный фосфор получают длительным нагреванием белого до 280–340 °С (в герметизированной аппаратуре). Наибольшие его количества потребляются спичечным производством.
Красный фосфор представляет собой порошок с плотностью 2,3, нерастворимый в сероуглероде и при нагревании возгоняющийся (т. возг. 416 °С). Пары его, сгущаясь, вновь дают белый фосфор. Последний, в противоположность красному, очень ядовит.
Химическая активность фосфора значительно выше, чем у азота. Так, он легко соединяет ся с кислородом, галоидами, серой и многими металлами. В последнем случае образуются аналогичные нитридам фосфиды (Mg3 P2 , Ca3 P2 и др.).
Белый фосфор значительно более реакционноспособен, чем красный. Например, белый фосфор медленно окисляется на воздухе даже при низких температурах и воспламеняется уже около 50 °С, тогда как красный фосфор на воздухе почти не окисляется, а воспламеняется лишь при 250°С. Точно так же и другие реакции протекают с белым фосфором гораздо энергичнее, чем с красным. Подобное различие реакционной способности аллотропических модификаций является общим случаем: из двух форм одного и того же вещества менее устойчивая обычно более активна.
1) Нагреванием белого фосфора до 220 °С под давлением 12 000 ат можетбыть получен черный фосфор с плотностью 2,7. Он похож по внешнему виду на графит, довольно хорошо проводит электричество и химически несколько менее активен, чем красный фосфор.
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например
Са3 Р2 + 6Н2 О = ЗСа(ОН)2 + 2РН3
может быть получен аналогичный аммиаку фосфористый водород («фосфин») – РН3 . Последний представляет собой бесцветный, весьма ядовитый газ (т. пл. –134 °С, т. кип. –88°С). Он имеет неприятный запах («гнилой рыбы»), легко воспламеняется на воздухе и является очень сильным восстановителем. В противоположность аммиаку реакции присоединения для фос–фина малохарактерны: соли фосфония (РН4 )известны лишь для немногих кислот (НСlO4 , НCl, HBr, HJ) и весьма нестойки, а с водой фосфин химически не взаимодействует (хотя довольно хорошо растворим в ней).
2) Наряду с РН3 при разложении .водой фосфидов всегда образуются небольшие количества аналогичного по составу гидразину жидкого фосфористого водорода – Р2 Н4 . Последний представляет собой бесцветную жидкость (т. пл. –99 СС, т. кип. 52 °С), самовоспламеняющуюся на воздухе.
Одним из применяемых для получения РН3 методов является нагревание белого фосфора с крепким водным раствором щелочи. Реакция идет, например, по уравнению:
8Р + ЗВа(ОН)2 + 6Н2 О = 2РН3 + ЗВа(Н2 РО2 )3
Одновременно образуется соль фосфорноватистой кислоты.
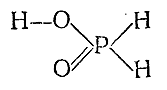
Действием на эту соль H2 SO4 может быть получена свободная фосфорноватистая кислота (Н3 РО2 ). Несмотря на наличие в ее молекуле трех водородов, она является только одноосновной кислотой (и довольно сильной), что согласуется со структурной формулой:
Соли фосфорноватистой кислоты (г и п о ф о сф и ты), как правило, бесцветны и хорошо растворимы в воде.
3) Фосфорноватистая кислота (K = 9·10–2) представляет собой бесцветные кристаллы (т. пл. 27 °С), хорошо растворимые в воде. В сильнокислой среде (особенно при нагревании) она является энергичным восстановителем. Например, соли ргути восстанавливаются ею до металла:
HgCl2 + H3 PO2 + H2 O = H3 PO3 + Hg + 2HCl
Напротив, в разбавленных растворах на холоду Н3 РО2 не окисляется ни кислородом воздуха, ни свободным иодом.
Взаимодействие фосфора с кислородом в зависимости от условий ведет к образованию различных продуктов. При сгорании фосфора в избытке кислорода (или воздуха) получается его высший окисел – фосфорный ангидрид (Р2 О5 ). Напротив, горение при недостатке воздуха или медленное окисление дает в результате главным образом фосфористый ангидрид (Р2 О3 ).
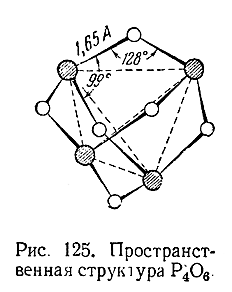
Последний представляет собой белую, похожую на воск кристаллическую массу (т. пл. 24 °С, т. кип. 175 °С). Определения его молекулярного веса приводят к удвоенной формуле (Р4 О6 ), которой отвечает показанная аа рис. 125 пространственная структуру.
При нагревании на воздухе фосфористый ангидрид переходит в Р2 О5 . Постепенно это окисление идет уже в обычных условиях, причем реакция сопровождается свечением, которое можно наблюдать в темноте. Взаимодействуя с водой, Р2 О3 –медленно образует фосфористую кислоту:
Р2 О3 + ЗН2 О = 2Н3 РО3
Подобно белому фосфору, фосфористый ангидрид очень ядовит.
Свободная фосфористая кислота(Н3 РО3 ) представляет собой бесцветные кристаллы, легкорастворимые в воде. Она является сильным (но в большинстве случаев медленно действующим) восстановителем. Несмотря на наличие в молеку ле трех водородов, Н3 РО3 функционирует только как двухосновная кислота средней силы. Соли ее (фосфористокислые, или фосфиты), как правило, бесцветны и труднорастворимы в воде. Из производных чаще встречающихся металлов хорошо рас–воримы лишь соли Na, К и Са.
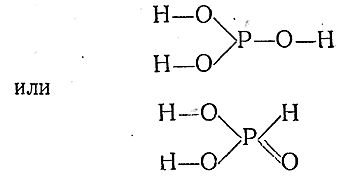
Строение фосфористой кислоты может быть выражено следующими структурными формулами:
Самой кислоте отвечает вторая формула, а производные ее известны для обеихструктур.
4) Фосфористую кислоту (т. пл. 74 °С, K1 = 2·10–2, К2 = 2 ·10–7) удобно получать гидролизом РСl3 и последующим упариванием жидкости до начала кристаллизации. Кислородом воздуха ее растворы при обычных условиях заметно не окисляются. Взаимодействие ее с хлорной ртутью медленно идет по уравнению
Н3 РО3 + 2НgСl2 +Н2 О = Н3 РО4 + Нg2 Сl2 + 2НСl.
Наиболее характерный для фосфора окисел – фосфорный ангидрид (Р2 О5 ) представляет собой белый аморфный порошок, не имеющий запаха и при сильном нагревании возгоняющийся.
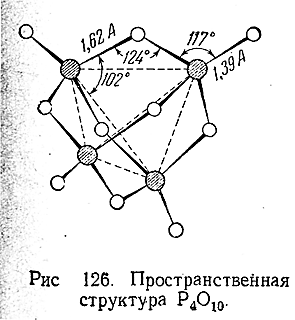
Определение его молекулярного, веса в парах указывает на удвоенную формулу – Р4 О10 , которой отвечает приводимая на Рис. 126 пространственная структура. Фосфорный ангидрид чрезвычайно энергично притягивает влагу и поэтому часто применяется в качестве осушителя газов.
Взаимодействие Р2 О5 с водой сопровождается ее присоединением, причем в зависимости от числа присоединенных молекул Н2 О возможно образование следующих основных гидратных форм:
P2 O5 + H2 O = 2HPO3 (метафосфорная кислота)
P2 O5 + 2H2 O = H4 P2 O7 (пирофосфорная кислота)
P2 O5 + 3H2 O = 2H3 PO4 (ортофосфорная кислота)
Как видно из приведенного сопоставления, наиболее богата водой орто–кислота, которую обычно называют просто фосфорной. При ее нагревании происходит отщепление воды, причем последовательно образуются пиро– и мета–формы:
2Н3 РО4 = Н2 О + Н4 Р2 О7
и
Н4 Р2 O7 = Н2 О+2НPO3
Обратно, при действии воды на мета–форму она переходит в пиро– и затем в орто–форму. Однако переход этот на холоду протекает крайне медленно. Поэтому каждая кислота реагирует как индивидуальное вещество. Их структурные формулы приводятся ниже:
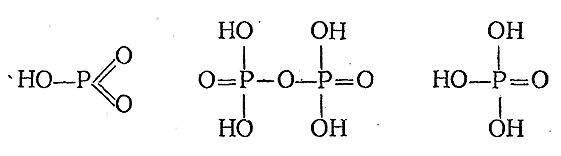
5) Для отличия ортофосфорной кислоты (K1 = 7·10–3, K2 = 6·10–8, K3 = 3·10–12) от мета– и пирофосфорной пользуются реакцией с AgNO3 ; в присутствии иона PO4 3–образуется желтый осадок Ag3 PO4 , а в присутствии ионов Р2 О7 4 –и РО3 –белый осадок соответствующей серебряной соли. Два последние кислоты отличают друг от друга по их разному действию на белок: пирофосфорная его не свертывает, метафосфорная свертывает.
Наибольшее практическое значение из кислот пятивалентного фосфора имеет ортогидрат (Н3 РО4 ). Получать его удобно окислением фосфора азотной кислотой по реакции:
ЗР + 5HNO3 + 2Н2 О = ЗН3 РО4 + 5NO
В производственном масштабе Н3 РО4 получают исходя из Р2 О5 , образующегося при сжигании фосфора (или его паров) на воздухе, Фосфорная кислота представляет собой бесцветные, расплывающиеся на воздухе кристаллы (т. пл.42°С). Продается она обычно в виде 85%–ного водного раствора, имеющего консистенцию густого сиропа. В отличие от других производных фосфора Н3 РО4 не ядовита. Окислительные свойства для нее вовсе не характерны.
Будучи трехосновной кислотой средней силы, Н3РО4 способна образовывать три ряда солей, например:
Кислые соли:
NaH2 PO4 [первичныйфосфорнокислый натрий]
Na2 HPO4 [вторичный фосфорнокислый натрий]
Средняя соль:
Na3 PO4 [третичный фосфорнокислый натрий]
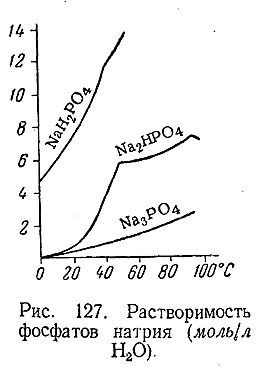
Все первичные фосфаты хорошо растворимы в воде, а из вторичных и третичных растворимы лишь очень немногие, в частности соли Na (рис. 127). Как правило, фосфаты бесцветны.
Производные фосфорной кислоты находят многообразное использование в различных отраслях промышленности. Однако особенно велико их значение для сельского хозяйства. В частности, это относится к кислому фосфату кальция состава Са(Н2 РО4 )2 ·Н2 О, который является основой важнейшего фосфорсодержащего минерального удобрения – суперфосфата. Выработка последнего в СССР по сравнению р 1913 г. увеличилась более чем в 100 раз.
6) Суперфосфат получают обработкой предварительно размолотых природных фосфоритов (или апатитных концентратов) серной кислотой.
После тщательного перемешивания влажная масса некоторое время «вызревает». При этом по схеме: Ca3 (PO4 )2 + 2H2 SO4 = 2CaSO4 + Са(Н2 РО4 )2
образуется смесь сульфата и первичного фосфата кальция, которая после измельчения и применяется в качестве удобрения (под названием простого суперфосфата). Входящий в состав хорошо растворимого Са(Н2 РО4 )2 фосфор легко усваивается растениями.
Большим недостатком рассматриваемого удобрения является наличие в нем бесполезного «балласта» в виде CaSO4 . Для получения т. н. двойного суперфосфата из природного фосфорита сначала выделяют фосфорную кислоту по реакции: Ca3 (PO4 )2 + 3H2 SO4 = 3CaSO4 + 2H3 PO4
Отделив осадок CaSO4 , полученной кислотой обрабатывают новую порцию фосфорита:
Са3 (РО4 )2 + 43 РО4 = ЗСа(Н2 РО4 )2
Иногда вместо этого нейтрализуют НзРО4 гидратом окиси кальция, причем осаждается т. н. преципитат (СаНРО4 ·2Н2 О), также являющийся хорошим удобрением. На многих почвах (имеющих кислый характер) фосфор довольно хорошо усваивается растениями непосредственно из тонко размолотого фосфорита (фосфоритной муки).
7) Для дальнейшего концентрирования необходимых растениям элементов большое значение приобретает выработка смешанных удобрений. Важнейшим из них является т. н. амофос [смесь NH4 H2 PO4 и (NH4 )2 HPO4 ], получаемый прямым взаимодействием аммиака и фосфорной кислоты. Тонна амофоса заменяет три тонны простого суперфосфата и одну тонну (NH4 )2 SO4 . Смесь амофоса с KNO3 (т. н. нитрофоска) особенно удобна для пользования, так как содержит все наиболее нужные растениям «удобрительные» элементы – N, Р и К.
Насколько велико потребление последних культурными растениями, видно из приводимых ниже примерных данных (в кг на тонну):
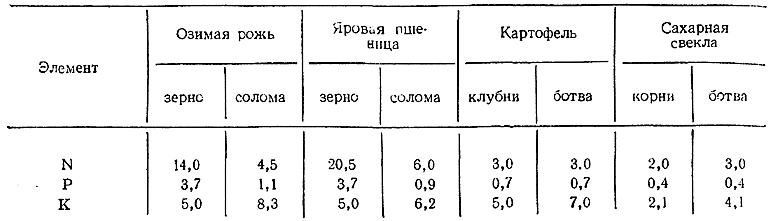
В результате урожаи ежегодно уносят с полей очень большие количества каждого из этих элементов, что приходится компенсировать внесением в почву удобрений. Обшая выработка минеральных удобрений по СССР составила в 1962 г. 17,3 млн. т (против 3,0 млн. т в 1940 г. и 0,07 млн. т в 1913 г.).
8) Взаимодействие между фосфором и серой наступает лишь при нагревании их смеси (в атмосфере СО2 ). Таким путем могут быть получены желтые сульфиды фосфора, из которых важнейшими являются отвечающие формулам P4 S3 , P4 S7 и P4 S10 . Образование того или иного из них зависит от относительных количеств обоих элементов. В сухом воздухе все три сульфида при обычных температурах устойчивы, но при нагревании воспламеняются и сгорают по реакции, например:
P4 S3 + 8O2 = 2P2 O5 + 3SO2
Галоидные соединения фосфора образуются путем взаимодействия элементов, протекающего, как правило, весьма энергично. Галогениды типов РГ3 и РГ5 (кроме PJ5 ) известны для всех галоидов, однако практическое значение из них имеют почтч исключительно производные хлора.
Треххлористый фосфор (РСl3 ) образуется при действии сухого хлора на взятый в избытке фосфор. Последний при этом воспламеняется и сгорает по реакции:
2Р + ЗСl2 = 2РСl3
Треххлористый фосфор представляет собой бесцветную жидкость, которая во влажном воздухе сильно дымит, а с водой энергично взаимодействует по уравнению:
РСl3 + ЗН2 О = Н3 РО3 + ЗНСl
Таким образом, РСl3 является хлора н гидридом фосфористой кислоты.
При действии на РСl3 избытка хлора образуются бесцветные кристаллы пятихлористого фосфора:
РСl3 + Сl2 < = > РСl5
При обычных условиях равновесие этой реакции смещено вправо, выше 300 °С – влево.
Будучи хлорангидридом фосфорной кислоты, PCl5 нацело разлагается водой, образуя Н3 РО4 и НСl. Реакция проходит в две стадии (вторая медленнее первой):
РСl5 + Н2 О = РОСl3 + 2НСl
и
РОСl3 + ЗН2 О = Н3 РО4 + ЗНСl
Получающаяся по первой из них хлорокись фосфора (РОСl3 ) представляет собой бесцветную жидкость. Подобно обоим хлоридам фосфора, его хлорокись находит применение при синтезах органических веществ. Пары всех трех соединений ядовиты.
9) Пространственное строение галогенидов РГ3 отвечает треугольным пирамидам с атомом Р в вершине. Их основные константы сопоставлены ниже:
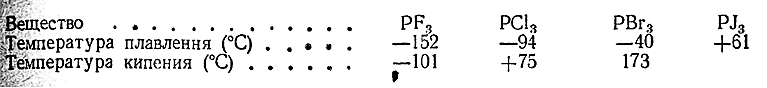
Йодистый фосфор имеет красный цвет, а остальные галогениды РГз бесцветны.
Из галогенидов РГ5 йодистое производное неизвестно. Пятифтористый фосфор представляет собой бесцветный газ (т. пл. –94 °С, т. кип. –85 °С), пятихлористый возгоняется при 159 °С, пятибромиетый (т. пл. 106 °С) известен в двух формах: красной и светло–желтой. В парах эти галогениды имеют структуры типа тригональной бипирамиды (рис. 128). Решетка кристаллического РСl5 состоит из ионов [РСl4 ]+ и [РСl6 ]–, а кристаллического РВr5 – из ионов [РВr4 ]+ и Вr–.
Для всех галогенидов фосфора характерна резко выраженная тенденция к реакциям присоединения. В качестве частного проявления ненасыщенного характера РСlз можно рассматривать постепенное (крайне медленное) окисление его кислородом воздуха до РОСl3 (т. пл. °С, т. кип. 107 °С). Водой все галогениды фосфора легко разлагаются.