Калия феррат (VI)
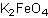
Внешний вид:
красно-фиолетов. кристаллыБрутто-формула (система Хилла): FeK2O4
Формула в виде текста: K2FeO4
Температура разложения (в °C): 120
Метод получения 1.
(лабораторный синтез)Источник информации: Ключников Н.Г. "Неорганический синтез" М. 1988 стр. 100
3 массовые части гидроксида натрия растворяют в 7,5 массовых частей воды и через раствор при охлаждении пропускают хлор, чтобы привес раствора составил 18-19%. Затем к раствору добавляют при взбалтывании 7 массовых частей измельченного гидроксида натрия. Раствор охлаждают до температуры 20°С и выпавший осадок соли отфильтровывают. К раствору (фильтрату) гипохлорита натрия добавляют отдельными порциями при взбалтывании 25 массовых частей девятиводного нитрата железа(III). К полученному раствору феррата натрия для осаждения прибавляют отдельными порциями 15 массовых частей насыщенного при температуре 30°С раствора гидроксида калия. Раствор все время перемешивают и охлаждают. Выпавший кристаллический осадок феррата калия промывают эфиром на стеклянном фильтре и высушивают в вакуум-эксикаторе.
Для очистки соль перекристаллизовывают: ее растворяют при непрерывном взбалтывании в охлажденном 3-4 М растворе гидроксида калия, профильтровывают и фильтрат переливают в равный объем концентрированного охлажденного раствора гидроксида калия. Выпавший осадок отсасывают на фильтре, промывают спиртом, эфиром и высушивают в вакуум-эксикаторе.
Стандартный электродный потенциал:
FeO42- + 4H2O + 3e- → FeO(OH) + 5OH-, E = 0,72 В (вода, 25 C)FeO42- + 8H+ + 3e- → Fe3+ + 4H2O, E = 1,9 В (вода, 25 C)
- "Справочник химика" т.3, Л.-М.: Химия, 1965 стр. 743
- "Химическая энциклопедия" т.2 М.: Советская энциклопедия, 1990 стр. 132
- Лидин Р.А., Аликбекова Л.Ю., Логинова Г.П. "Неорганическая химия в вопросах" М.: Химия, 1991 стр. 173-174
