2.3.3. Осмотическое давление
В истинных растворах, отделенных от растворителя полупроницаемой перегородкой, может быть измерено осмотическое давление, величина которого зависит от концентрации растворенного вещества и для разбавленных растворов описывается уравнением Вант Гоффа
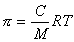 , (2.2.96)
, (2.2.96)
где С – массовая концентрация, кг/м3.
Для коллоидных систем можем записать
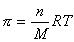 , (2.2.97)
, (2.2.97)
где n – частичная концентрация частиц/м3.
Грэм пытался определить осмотическое давление коллоидных растворов и пришел к ошибочному выводу, что коллоидные системы этим свойством не обладают. Как известно, именно на этом ошибочном факте Грэм провел разделение на истинные растворы и коллоидные системы.
Однако тот факт, что частицы в коллоидном состоянии также совершают хаотическое движение, не оставляет сомнений в том, что осмотическое давление должно быть и у коллоидных систем.
Из уравнения (2.2.97) следует, что осмотическое давление пропорционально частичной концентрации. Число частиц в коллоидной системе очень мало по сравнению с истинным раствором, поэтому осмотическое давление золей тоже очень мало. Например,1%-ный золь золота с частичками r» 10-9м имеет осмотическое давление p = 3,45 Па. Чтобы этот золь имел такое же осмотическое давление, как 1М-раствор электролита, понадобилось бы в 1 дм3 диспергировать 50 кг золота с частичками r = 10-9 м.
Очевидно, что при малом осмотическом давлении золя даже малейшая примесь электролита будет оказывать колоссальное влияние на осмотическое давление, поэтому при изучении осмоса в золях их требуется тщательно очищать.
Смолуховский показал, что при изменении степени дисперсности коллоида осмотическое давление обратно пропорционально r3частиц, т.е.
p1/p2 = (r2/r1)3. (2.2.98)
Пфеффер первый определил «молекулярную массу» частиц в золе и показал, что она необычайно велика:
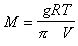 , (2.2.99)
, (2.2.99)
где g – навеска вещества; V – объем раствора.
Рис. 2.15. Схема конуса Тиндаля: 1- лампа, 2- конденсор, 3 - линза, 4- золь, 5 - луч света |
Осмотическое давление раствора высокомолекулярного вещества также отличается от осмотического давления раствора низкомолекулярного вещества. В области разбавленных растворов осмотическое давление у растворенных полимеров будет больше, чем у золей.
Молекулярная масса высокомолекулярных соединений может быть определена путем измерения осмотического давления. Для этих растворов
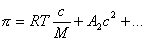 . (2.2.100)
. (2.2.100)
или
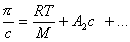 . (2.2.101)
. (2.2.101)
По углу наклона зависимости, описываемой выше определяется интенсивность взаимодействия макромолекул с растворителем, характеризуемая величиной А2. При одной и той же массовой концентрации в растворах полимеров большие молекулы присутствуют в меньшем количестве, чем число молекул низкомолекулярных веществ, поэтому осмотическое давление в таких растворах будет ниже, чем в растворах низкомолекулярных веществ.


