Растворы полимеров
РАСТВОРЫ ПОЛИМЕРОВ, обладают рядом особенностей по сравнению с р-рами низкомол. в-в из-за св-в макромолекул: больших размеров, широкого диапазона гибкости (жесткости), большого набора конформаций, способности к конформац. перестройкам при изменении т-ры, р-рителя и т.п.
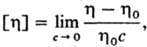
В разбавленных растворах полимеров гибкоцепные синтетич. макромолекулы принимают конформацию статистич. клубка, в объеме к-рого концентрация с0 собств. звеньев весьма мала (порядка 1% по массе и менее) и убывает с ростом мол. массы. Влияние мол. массы и геом. характеристик макромолекул на св-ва растворов полимеров приводит к тому, что концентрация растворенного в-ва не является однозначным критерием разделения растворов полимеров на разбавленные и концентрированные, в отличие от р-ров низкомол. в-в. Раствор полимера со средней концентрацией с растворенного в-ва считается разбавленным, если с < с0, т. е. среднее расстояние между макромолекулами значительно больше их размера. Условный показатель, характеризующий уд. объем, занимаемый макромолекулой,-характеристическая вязкость, где h и h0-соотв. вязкость р-ра с концентрацией с и вязкость чистого р-рителя. Величина [h]-условный показатель, определяющий прирост вязкости р-рителя при введении в него полимера. Если концентрация раствора полимеров выражена в г/л, то единица характеристич. вязкости-л/г или м3/кг. Раствор полимеров является "разбавленным", если [h]c < 1. Разбавленные растворы полимеров используют для изучения характеристик индивидуальных макромолекул: мол. массы, размеров, конформаций, гибкости цепи и т.п. Интервал концентраций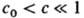 определяет т. наз. полуразбавленный раствор полимеров: концентрация полимера мала, но статистич. клубки перекрываются, проникая друг в друга. Клубковые конформации макромолекул сохраняются и в концентрированных растворах полимеров, а также в сверхконцентрированных растворах полимеров, примером к-рых служат полимеры, пластифицированные труднолетучими р-рителями (см. Пластификация полимеров).
определяет т. наз. полуразбавленный раствор полимеров: концентрация полимера мала, но статистич. клубки перекрываются, проникая друг в друга. Клубковые конформации макромолекул сохраняются и в концентрированных растворах полимеров, а также в сверхконцентрированных растворах полимеров, примером к-рых служат полимеры, пластифицированные труднолетучими р-рителями (см. Пластификация полимеров).
Др. особенность растворов полимеров-понижение совместимости компонентов из-за того, что энтропия смешения DSс снижается при соединении мономеров в единую цепь. Полное смешение полимеров с низкомол. р-рителями возможно лишь в определенном интервале т-р. Вне этого интервала взаимная р-римость компонентов становится ограниченной и происходит разделение растворов полимеров на две фазы, сосуществующие в равновесии.
На гипотетич. обобщенной диаграмме р-римости в координатах концентрация полимера с-т-ра T (рис. 1) имеется кривая (бинодаль), отделяющая замкнутую область т-р и концентраций, внутри к-рой раствор полимеров расслаивается на две фазы. Максимум и минимум на бинодали определяют верхнюю и нижнюю критич. т-ры смешения (соотв. ВКТС и НКТС) и критич. концентрации. В критич. точках составы сосуществующих фаз полимер - р-ритель совпадают. При т-рах вне интервала ВКТС-НКТС имеет место неограниченное взаимное смешение компонентов, причем ниже НКТС - за счет сильного взаимод. активных атомных групп полимера и р-рителя, напр. за счет водородных связей. Вблизи критич. т-ры перехода жидкость-пар (НКТС') также имеется область ограниченной совместимости.
Реальная полная диаграмма р-римости полимера с тремя критич. т-рами до сих пор не получена. Наиб. часто проявляется на практике лишь ВКТС (хотя она может лежать выше точки кипения р-рителя), а НКТС не достигается, чаще всего из-за высокой т-ры замерзания р-рителя. Имеются и системы, в к-рых существует лишь НКТС.
Форма и положение бинодали для данной пары полимер -р-ритель зависит от мол. массы. С ростом мол. массы М полимера бинодаль смещается в сторону малых концентраций и больших т-р, критич. концентрация скр ~ 1/М1/2, 1/Ткр линейно убывает с убыванием 1/М1/2 (пунктирная линия на рис. 1), т.е. р-римость полимера уменьшается. Такая зависимость используется для фракционирования полимеров по мол. массе. Предельное значение Ткр при М : со определяет т. наз. 9-температуру Флори (q-точку, q-усло-вие) как идеальную т-ру, при к-рой клубкообразные макромолекулы в р-ре имеют конформацию гауссова клубка, т. е. их средний квадратичный линейный размер R пропорционален М1/2, а с0 ~ 1/М1/2. С ростом т-ры размеры макромолекулы в разб. р-рах увеличиваются до R ~ М0,6, с0 ~ М-0,8 (р-ритель "улучшается"). Предельная концентрация с0 убывает с ростом мол. массы полимера, а при данной мол. массе-с ростом т-ры.
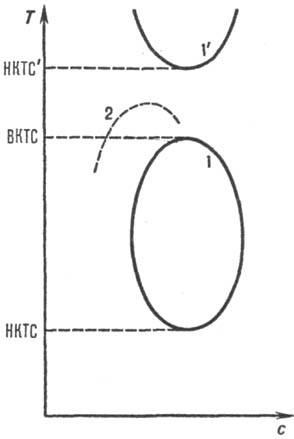
Рис. 1. Обобщенная диаграмма р-римости для системы аморфный полимер— р-ритель. На осях отложены концентрация полимера с и т-ра Т. Кривые 1 и Г — бинодали, ВКТС, НКТС и НКТС'-соотв. верхняя и две нижние критич. т-ры смешения; пунктирная кривая 2 показывает смещение бинодали 1 при увеличении мол. массы полимера.
Теория, позволяющая определить пределы совместимости полимера и р-рителя в зависимости от мол. массы растворенного в-ва и т-ры, развита П. Дж. Флори и М. Хаггинсом в 40-х гг. 20 в. Энтропия смешения DSc системы полимер-р-ритель рассчитывалась на основе решеточной модели (см. Жидкость), согласно к-рой жидкость м.б. представлена квазирешеткой, в каждой ячейке к-рой может помещаться либо молекула р-рителя, либо равный ей по размерам участок макромолекулы, что связано с конкретной конфор-мацией цепи. Соответственно при расчете энтропии смешения DSc принимаются во внимание лишь допустимые кон-формации, а при малой молярной доле полимера в р-ре возможны большие значения DSc. Наличие отличной от нуля теплоты смешения DHс обусловлено тем, что энергия межмол. взаимод. в чистых в-вах-р-рителе и полимере— отличается от энергии взаимод. р-ритель-полимер. Избыточная своб. энергия взаимод., приходящаяся на одну молекулу р-рителя в растворе полимеров, характеризуется полуэмпирич. параметром Флори-Хаггинса c, к-рый для данной пары полимер - р-ритель является ф-цией т-ры. С параметром X связан второй вириальный коэф. А2 разложения осмотич. давления р-ра в ряд по концентрации, позволяющий оценить "качество" р-рителя. Если контакты полимер - полимер и р-ритель - р-ритель энергетически менее выгодны, чем контакты полимер-р-ритель, коэф. А2 > 0, р-ритель считается хорошим. Р-рители с А2 < 0 считаются плохими, р-ри-мость полимера в них ограничена. При А2 = 0 р-ритель наз. квазиидеальным или q-растворителем, а т-ра, при к-рой положит. энтальпия смешения компенсируется возрастанием энтропии, является q-точкой. Для растворов полимеров q-точка аналогична точке Бойля для реальных газов (см. Вириальное уравнение).
Для жесткоцепных полимеров (напр., при длине жесткого сегмента 10 нм и выше) наблюдается ухудшение р-римости сравнительно с гибкоцепными полимерами, совместимость компонентов растворов полимеров часто достигается за счет сильных взаимод. полимер-р-ритель. Р-римость полимера повышается при наличии у макромолекул подвижных боковых групп атомов. Р-ры жесткоцепных полимеров изотропны лишь при концентрации ниже нек-рой критической, при повышении концентрации на диаграмме р-римости наблюдается узкая область двухфазного состояния, а затем состояние полимерного жидкого кристалла (рис. 2). В изотропных растворах полимеров вязкость сильно возрастает с концентрацией, в жидких кристаллах макромолекулы ориентационно упорядочены, что обеспечивает уменьшение вязкости.
Рис. 2. Равновесная кривая сосуществования фаз в системе полимер ^р-ритель. По осям отложены концентрация полимера с и т-ра Т. Буквами И и А обозначены области существования изотропного и анизотропного р-ров соответственно.
Биол. макромолекулы (белки, нуклеиновые к-ты) и их модели (полипептиды, полинуклеотиды) в р-рах могут иметь специфич. конформации, стабилизированные внутри-мол. взаимодействием . Так, нативные глобулярные конформации белков в водном р-рителе стабилизированы водородными связями и гидрофобными взаимодействиями неполярных групп атомов. Полярные группы на пов-сти глобулы обеспечивают ее р-римость. При изменении состава и св-в р-рителя, рН и ионной силы р-ра или при изменении т-ры происходят внутримол. конформац. переходы типа спираль-клубок и глобула-клубок, что приводит к резкому изменению всех св-в раствора полимеров.
Лит.: Цветков В. Н., Эскин В. Е., Френкель С. Я., Структура макромолекул в растворах, М., 1964; Папков С. П., Равновесие фаз в системе полимер-растворитель, М., 1981; Жен П.-Ж., Идеи скейлинга в физике полимеров, пер. с франц., М., 1982. Т. М. Бирштейн.
