Глутамилтрансфераза
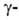 ГЛУТАМИЛТРАНСФЕРАЗА
[(5-глутамил)пептид : аминокислота 5-глутамилтрансфераза], фермент класса
транс-фераз, катализирующий перенос остатка глутаминовой к-ты на какой-либо
акцептор:
ГЛУТАМИЛТРАНСФЕРАЗА
[(5-глутамил)пептид : аминокислота 5-глутамилтрансфераза], фермент класса
транс-фераз, катализирующий перенос остатка глутаминовой к-ты на какой-либо
акцептор:
где R-остаток аминокислоты, пептида или группа ОН; А-акцептор остатка
глутаминовой к-ты (гл. обр. кодируемая аминокислота,
а также нек-рые дипептиды, Н2О, NH2OH). Специфичность
глутамилтрансферазы к акцепторам значительно варьирует у разл. организмов. У млекопитающих
наиб. сродством к ферменту обладают глицилглицин, L-цистин, L-глутамин
и L-метионин. К пролину глутамилтрансфераза абсолютно неспецифична.
аминокислота,
а также нек-рые дипептиды, Н2О, NH2OH). Специфичность
глутамилтрансферазы к акцепторам значительно варьирует у разл. организмов. У млекопитающих
наиб. сродством к ферменту обладают глицилглицин, L-цистин, L-глутамин
и L-метионин. К пролину глутамилтрансфераза абсолютно неспецифична.
В организме глутамилтрансфераза ответствен за биосинтез глутамилпеп-тидов
и, возможно, за их перенос через клеточную мембрану в т. наз.
глутамилпеп-тидов
и, возможно, за их перенос через клеточную мембрану в т. наз.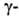 глутамильном
цикле. Он также участвует в деградации глутатиона (больные с врожденной
недостаточностью глутамилтрансферазы обнаруживают глутатионемию и глутатионурию) и играет
роль в реакциях детоксикации.
глутамильном
цикле. Он также участвует в деградации глутатиона (больные с врожденной
недостаточностью глутамилтрансферазы обнаруживают глутатионемию и глутатионурию) и играет
роль в реакциях детоксикации.
Глутамилтрансфераза-гликопротеид. Существует в двух формах (мол. м. 200 тыс. и 68-92
тыс.), молекулы к-рых состоят из двух субъединиц. На одной из них (с меньшей
мол. массой) расположен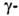 глутамилсвязывающий
участок, другая участвует в связывании фермента с мембранами клетки. Оптим.
каталитич. активность глутамилтрансферазы проявляется обычно при рН 8,2, при переносе остатка
глутаминовой к-ты на Н2О - ниже рН 7.
глутамилсвязывающий
участок, другая участвует в связывании фермента с мембранами клетки. Оптим.
каталитич. активность глутамилтрансферазы проявляется обычно при рН 8,2, при переносе остатка
глутаминовой к-ты на Н2О - ниже рН 7.
Глутамилтрансфераза может ингибироваться необратимо, напр. 6-диазо-5-окco-L-норлейцином,
и обратимо, напр. серином в присут. солей борной к-ты,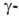 глутамилгидразонами
глутамилгидразонами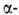 кетокислот
и
кетокислот
и глутамилфенилгидразидами.
Представители двух последних групп в-в ингибируют глутамилтрансферазу по конкурентному механизму
(т.е. вытесняют субстрат из фермент-субстратного комплекса).
глутамилфенилгидразидами.
Представители двух последних групп в-в ингибируют глутамилтрансферазу по конкурентному механизму
(т.е. вытесняют субстрат из фермент-субстратного комплекса).
Глутамилтрансфераза содержится в тканях животных (гл. обр. в почках) и растений. В пределах одного класса животных она иммунологически однородна и отличается только составом небелковой компоненты. При нек-рых заболеваниях печени и поджелудочной железы активность глутамилтрансферазы в сыворотке крови повышается, что используется в диагностич. целях.
===
Исп. литература: Горленко В. А., Филиппович Ю. Б., "Успехи современной биологии", 1979, т. 88, в. 3 (6), с. 367-86; Tate S. S., Meister A., "Molecular and Cellular Biochemistry", 1981, v. 39, p. 357-68. В. А. Горленко.