Натрия хромат
НАТРИЯ ХРОМАТ Na2CrO4, желтые кристаллы; до 423 °С устойчива орторомбич. модификация (а = 0,717 нм, b= = 0,924 нм, с = 0,588 нм, z = 4, пространств. группа Pnmb), выше 423°С-гексагональная; DH перехода 9,62 кДж/моль; т.пл. 794°С; плотн. 2,72 г/см3; С0p 142,1 Дж/(моль.К); DH0обр -1343 кДж/моль, DH0пл 24,69 кДж/моль; S0298 176,6 Дж/(моль•К); показатели преломления: меньший Np=l,78, больший Ng = 2,77. Р-римость в воде 45,8% по массе (25 °С); DH0 растворения для бесконечно разб. р-ра — 1362,4 кДж/моль. Раств. в метаноле, плохо - в этаноле. Из водных р-ров ниже 19,52 oС кристаллизуется декагидрат (DH0обр — 4276,9 кДж/моль), в интервале 19,52-26,6 °С-гексагид-рат, в интервале 26,6-62,8 °С - тетрагидрат (DH0обр- 2526,5 кДж/моль), выше 62,8°С-безводная соль. В водном р-ре натрия хромат существует равновесие Сr2O2-7 + Н2О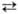 2 НСrO-4
2 НСrO-4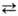 2СrO2-4 + 2Н+ . При действии к-т натрия хромат превращается в дихромат Na2Cr2O7. При медленном добавлении конц. H2SO4 к почти насыщ. водному р-ру натрия хромата образуются многоядерные анионы изополикислот: Cr3O2-10 и Cr4O2-13. Натрия хромат-сильный окислитель, напр. восстанавливается H2S в щелочной среде до Na3[Cr(OH)6], серой-до Сr2О3 (пром. способ). С кремнием при натр. образует CrSi2, при сплавлении с РbO-РbСrО4.
2СrO2-4 + 2Н+ . При действии к-т натрия хромат превращается в дихромат Na2Cr2O7. При медленном добавлении конц. H2SO4 к почти насыщ. водному р-ру натрия хромата образуются многоядерные анионы изополикислот: Cr3O2-10 и Cr4O2-13. Натрия хромат-сильный окислитель, напр. восстанавливается H2S в щелочной среде до Na3[Cr(OH)6], серой-до Сr2О3 (пром. способ). С кремнием при натр. образует CrSi2, при сплавлении с РbO-РbСrО4.
Получают натрия хромат прокаливанием (1100-1200 oC) смеси FeCr2O4 и Na2CO3 с послед. выщелачиванием и кристаллизацией, взаимод. NaOH с СrO3, окислением Сr2О3 нитратом Na,
NaClO3 или Na2O2 при натр., а в присут. О2-р-цией с NaOH и Na2CO3. Натрия хромат-окислитель в орг. синтезе и произ-ве красителей, дубитель в кожевенной пром-сти, протрава при крашении тканей, промежут. продукт при получении Сr2О3. Токсичен, ПДК 0,01 мг/м3 (в пересчете на СrO3).
Г. П. Логинова.
