Тримолекулирные реакции
ТРИМОЛЕКУЛЯРНЫЕ РЕАКЦИИ, элементарные р-ции, в к-рых химически изменяются три молекулы. Скорость тримолекулярных реакций w равна среднему числу n3 групп из трех частиц А, В, С, сосредоточенных в нек-ром эффективном объеме u действия межмол. сил, умноженному на вероятность w осуществления р-ции в такой группе в единицу времени: w = n3w. В рамках представлений формальной хим. кинетики п3 = = (u/V)2nАnBnC, u = 4pd3/3, где V-объем системы, nА, пB, пC- числа частиц А, В, С в этом объеме, d ! 0,1 нм-эффективный диаметр частиц. Константа скорости р-ции k = = (u/V1)2w, где V1 = 1 см3.
Если в результате тримолекулярной реакции образуется не менее двух частиц (напр., NO + NO + Cl2 : 2NOCl), макс. значение вероятности р-ции wмакс определяется временем т ухода продуктов из объема u:

где 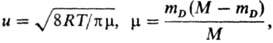 mD-мол. масса легчайшей из частиц-продуктов, М = mA + mB + mC-суммарная мол. масса реагирующих частиц, R-газовая постоянная, Т-абс. т-ра. Если же в результате тримолекулярной реакции образуется одна молекула ABC, то wмакс определяется временем, в течение к-рого группа из трех несвязанных частиц стабилизируется путем столкновения с четвертой частицей. В этом случае при сравнимых массах всех трех частиц, равных, напр., mА, wмакс также м.б. выражена ф-лой (1), но m!mА. Порядок величины (u/V1)2wмакс составляет 10-31 — 10-33 см6/с, т.е. 1012 - 1010 см6/(моль2·с). В общем случае для любой тримолекулярной реакции w = wмаксРехр(—E/RT), а константу скорости можно выразить ур-нием Аррениуса k = A(T)exp(-E/RT), где A(Т) = (u/V1)2wмакс, P - предэкспоненц. множитель, Е-энергия активации, определяемая высотой потенц. барьера на, координате реакции. Величина P
mD-мол. масса легчайшей из частиц-продуктов, М = mA + mB + mC-суммарная мол. масса реагирующих частиц, R-газовая постоянная, Т-абс. т-ра. Если же в результате тримолекулярной реакции образуется одна молекула ABC, то wмакс определяется временем, в течение к-рого группа из трех несвязанных частиц стабилизируется путем столкновения с четвертой частицей. В этом случае при сравнимых массах всех трех частиц, равных, напр., mА, wмакс также м.б. выражена ф-лой (1), но m!mА. Порядок величины (u/V1)2wмакс составляет 10-31 — 10-33 см6/с, т.е. 1012 - 1010 см6/(моль2·с). В общем случае для любой тримолекулярной реакции w = wмаксРехр(—E/RT), а константу скорости можно выразить ур-нием Аррениуса k = A(T)exp(-E/RT), где A(Т) = (u/V1)2wмакс, P - предэкспоненц. множитель, Е-энергия активации, определяемая высотой потенц. барьера на, координате реакции. Величина P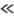 1 суть стерич. фактор, выражающий весьма малую вероятность образования активир. комплекса при произвольной ориентации сталкивающихся частиц. Для тримолекулярной реакции NO + NO + Сl2 : 2NOC1 экспериментально определенная константа скорости k = 10-35,08b0,37ехр[(-22 кДж/моль)/RT]см6/с.
1 суть стерич. фактор, выражающий весьма малую вероятность образования активир. комплекса при произвольной ориентации сталкивающихся частиц. Для тримолекулярной реакции NO + NO + Сl2 : 2NOC1 экспериментально определенная константа скорости k = 10-35,08b0,37ехр[(-22 кДж/моль)/RT]см6/с.
Множитель А (Т)может существенно возрасти, если к.-л. пары разноименных частиц А, В, С образуют долгоживущие комплексы, в к-рых исходные частицы, сохраняя свою хим. индивидуальность, состав и строение, удерживаются межмол. силами типа ван-дер-ваальсовых. Необходимые условия образования таких комплексов след.: 1) отношение энергии связи e частиц в комплексе удовлетворяет условию: ехр(e/RТ)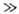 1; 2) по крайней мере одна из двух частиц комплекса не является одноатомной.
1; 2) по крайней мере одна из двух частиц комплекса не является одноатомной.
Иногда к тримолекулярным реакциям относят р-ции рекомбинации типа А + В + + М:АВ + М, в к-рых частица М не изменяется и играет лишь роль катализатора, переводящего нестабильную пару сталкивающихся частиц А и В в стабильную молекулу АВ.
Лит.: Кондратьев В. Н., Константы скорости газофазных реакций. Справочник, М., 1970. Н. М. Кузнецов.
