Кинетика химических реакций
Изменение свободной энергии (ΔG) дает информацию о том, может ли идти данная реакция в заданных условиях и какая для этого потребуется работа. Однако при этом ничего нельзя сказать о кинетическом параметре, т.е. о скорости химической реакции.
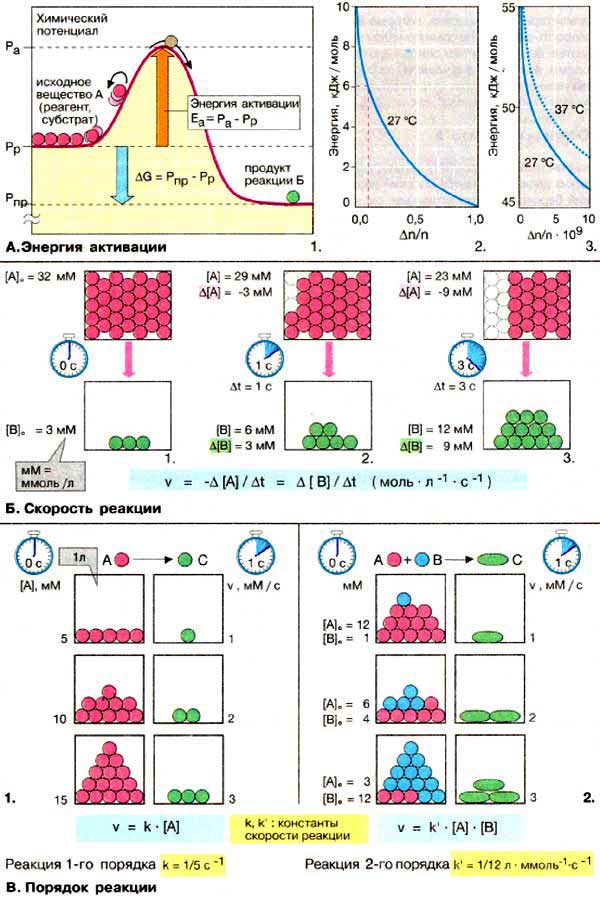
Большинство органических химических реакций (за исключением реакций кислот и оснований, см. с. 36) протекают очень медленно, независимо от величины ΔG. Главная причина низкой скорости реакции состоит в том, что для вступления в реакцию молекулы реагента должны обладать определенной минимальной энергией, называемой энергией активации. Наглядно это можно представить с помощью энергетической диаграммы наиболее простой реакции А — > B (1). Каждое из соединений, реагент А и продукт реакции В, обладает· определенным химическим потенциалом (Pp и Рnp соответственно). Изменение свободной энергии реакции (ΔG) соответствует разности потенциалов. Для превращения в В соединение А должно преодолеть энергетический барьер, пик которого Pa выше Рp, Разность потенциалов Ра - Pp носит название энергия активации (Eа).
В пользу того, что A, в принципе, может превратиться в B, свидетельствует то обстоятельство, что Pp является средним значением потенциала для всех молекул, вступающих в реакцию. Время от времени отдельные молекулы достигают гораздо более высокого потенциала, например за счет столкновения с другими молекулами. Если в результате столкновения энергия молекулы превысит Eа, эта молекула перейдет энергетический барьер и превратится в В. На рис. 2 и 3 приведено распределение энергии для молекулярных ансамблей, рассчитанное на простой модели. Δn/n это та часть молекул, которая обладает (или превышает) энергией E (в кДж/моль). Например, при 27°С около 10% молекул обладают энергией около 6 кДж/моль. Энергия активации химических реакций обычно существенно выше. Аналогичный график для реакции с энергией активации около 50 кДж/моль приведен на рис. 3. Статистически при 27°С такой энергией обладает только 2 из 109 молекул, при 37°С — четыре молекулы (3). Подобная зависимость позволяет объяснить найденный эмпирическим путем температурный коэфициент скорости биологических процессов Q10, который означает, что при повышении температуры на 10°С скорость реакции возрастает в 2 раза.
Б. Скорость реакции
Скорость химической реакции определяют по изменению концентрации одного из реагентов или продуктов реакции за определенный период времени. В приведенном примере в 1 л раствора за 1 с расходуется 3 ммоля реагента и, в результате образуется 3 ммоля продукта. Это соответствует скорости реакции
v = ЗмМ · с-1 = 3 · 10-3 моль · л-1 · с-1
Скорость реакции зависит не только от энергии активации и температуры, но и от концентрации реагентов. Если имеется лишь один субстрат А (1), то скорость ν прямо пропорциональна концентрации [A]; это реакция первого порядка. Если в реакции участвуют два реагента А и В (2), то речь идет о реакции второго порядка. В таком случае ν пропорциональна произведению концентрации реагентов. Коэфициенты k и k' — константы скорости реакции — зависят от типа реакции и условий ее проведения.
На схеме Б приведена кинетика простых необратимых реакций. Обратимые или многоступенчатые реакции могут быть разделены на промежуточные реакции первого или второго порядка и описаны с помощью соответствующих уравнений.


