Финкельштайна реакция
ФИНКЕЛЬШТАЙНА РЕАКЦИЯ (Конанта - Финкельштайна р-ция), замещение хлора или брома в орг. соед. на иод при действии иодидов металлов:

Наиб. легко в Финкельштайна реакцию вступают 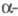 галогенкарбонильные соед., аллил- и бензилгалогениды. Легкость обмена галогенами уменьшается в ряду алкилгалогенидов: первичные > вторичные > третичные. Бромиды обычно более реакционноспособны, чем хлориды. Обмен галогена в ароматич. кольце возможен лишь при наличии электроноакцепторного заместителя. Винилбромиды дают удовлетворит, выходы иодидов при действии KI в присут. катализатора - смеси NiBr2 с цинком.
галогенкарбонильные соед., аллил- и бензилгалогениды. Легкость обмена галогенами уменьшается в ряду алкилгалогенидов: первичные > вторичные > третичные. Бромиды обычно более реакционноспособны, чем хлориды. Обмен галогена в ароматич. кольце возможен лишь при наличии электроноакцепторного заместителя. Винилбромиды дают удовлетворит, выходы иодидов при действии KI в присут. катализатора - смеси NiBr2 с цинком.
Р-цию проводят в р-рителе (ацетоне, метилэтилкетоне, H2O, CH3OH); чаще используют ацетон, обеспечивающий р-римость наиб, часто используемого иодирующего агента NaI и выведение из р-ции (выпадение в осадок) NaCl или NaBr, что смещает равновесие р-ции в сторону образования RI.
Обычно смесь иодида металла и RHal в р-рителе кипятят с обратным холодильником до прекращения выпадения осадка хлорида или бромида металла [напр., при получении (CH3)3CCH2I из бромида и NaI - 48 ч]. Выходы колеблются в широких пределах; в случае реакционноспособных орга-нилбромидов они составляют 80-90%, при использовании третичных алкилхлоридов - 20-40% (выход повышается при проведении р-ции в присут. ZnCl2 в среде CS2).
Осн. побочные продукты - олефины (результат дегидрога-логенирования RHaI), а также спирты и простые эфиры.
По механизму Финкельштайна реакция- типичное бимол. нуклеоф. замещение (SN2), сопровождающееся обращением конфигурации.
Финкельштайна реакцию используют в препаративной практике для синтеза орг. иодидов, к-рые трудно или невозможно получить др. способами (напр., непосредственным иодированием), а также в аналит. химии - для качеств. обнаружения орг. хлоридов и бромидов.
Р-ция открыта Г. Финкельштайном в 1910.
Лит.: Шрайнер Р., Фьюзон Р., Систематический качественный анализ органических соединений, пер. с англ., M., 1950; Treib s W. [u. a.], "Chem. Вег.", 1960, Bd 93, № 10, S. 2198-208. Г.И. Дрозд.
