Стереохимия этиленовых соединений
У предельных соединений все четыре ковалентные связи у атомов углерода относятся к типу σ-связей. Это обусловливает тетраэдрическое расположение его заместителей, причем угол между направлениями σ-связей должен составлять 109° 28'. Следовательно, для этого случая мы и теперь вправе пользоваться тетраэдрической моделью Вант-Гоффа.
В случае двух атомов углерода, связанных σ-связью, мы получим модель, изображенную на рис. 23.
Гипотеза Вант-Гоффа допускала возможность неограниченного вращения таких тетраэдров около линии, соединяющей их центры. Этим объясняли отсутствие какой-либо изомерии, обусловленной различным поворотом этих тетраэдров друг относительно друга.
Теперь необходимо признать, что такое вращение 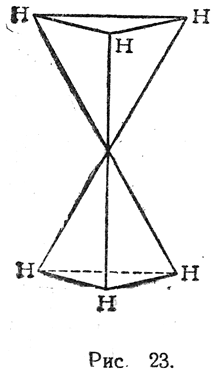 все же в некоторой мере ограничено. Более детальное изучение свойств молекул показывает, что свободное вращение тормозится из-за взаимодействия различных заместителей при атомах углерода, связанных простой связью (σ-связью). В молекуле этана, например, атомы водорода вследствие отталкивания друг от друга стремятся занять такое положение, при котором верхний тетраэдр повернут на 60° по отношению к нижнему (это иллюстрирует проекция на рис. 24). Такое расположение энергетически выгоднее (на 2,8 ккал/моль) расположения, при котором атомы водорода расположены друг над другом. Однако запас энергии у молекул этана при средних температурах вполне достаточен для того, чтобы повороты, несмотря на это, могли легко совершаться (до одного раза в 10–10 сек).
все же в некоторой мере ограничено. Более детальное изучение свойств молекул показывает, что свободное вращение тормозится из-за взаимодействия различных заместителей при атомах углерода, связанных простой связью (σ-связью). В молекуле этана, например, атомы водорода вследствие отталкивания друг от друга стремятся занять такое положение, при котором верхний тетраэдр повернут на 60° по отношению к нижнему (это иллюстрирует проекция на рис. 24). Такое расположение энергетически выгоднее (на 2,8 ккал/моль) расположения, при котором атомы водорода расположены друг над другом. Однако запас энергии у молекул этана при средних температурах вполне достаточен для того, чтобы повороты, несмотря на это, могли легко совершаться (до одного раза в 10–10 сек).
В случае длинных углеводородных цепей благодаря возможности вращения отдельных атомов вокруг общих осей (связей) молекулы могут располагаться в пространстве по-разному, временно изгибаясь под различными углами и даже образуя спирали. Для углеводородных цепей нормального строения и не слишком большой длины энергетически наиболее выгодным является расположение в виде плоского зигзага.
Для двойной связи модели Вант-Гоффа приводят к представлению о смыкании тетраэдров по общему ребру (рис. 25).
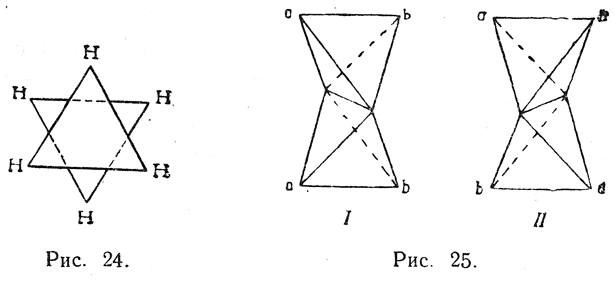
Такое представление, конечно, дает неправильную картину распределения в пространстве валентных связей в молекуле, в которой каждый из двух атомов углерода, образующих двойную связь, связан с другими атомами тремя σ-связями и одной π-связью. Однако эти модели дают все же правильное представление о положении четырех заместителей при атомах углерода, связанных двойной связью. А именно, эти заместители а,b,а,b оказываются лежащими в одной плоскости так же, как этого требует современная теория кратных связей для атомов углерода, связи которых характеризуются sр2-гибридизацией.
Поэтому мы и здесь можем в дальнейшем условно, для наглядности, пользоваться тетраэдрическими моделями.
Из рассмотрения тетраэдрической модели вытекает, что если заместители а и b (атомы и радикалы) при каждом из двух атомов углерода различны, то возможны два разных пространственных расположения этих заместителей. В модели I оба заместителя а находятся по одну сторону, а оба заместителя b — по другую сторону плоскости, проходящей через атомы углерода и линии их валентностей, образующих двойную связь; в модели же II по каждую сторону этой плоскости находится по одному заместителю а. Модели I и II различны, но не относятся друг к другу, как предмет к своему зеркальному изображению; их можно изобразить также проекционными формулами:

Подобные же две конфигурации получаются, если с атомами углерода соединены не два, а три или четыре различных заместителя, например:

Таким образом, для производных этилена, кроме структурной изомерии, можно ожидать также и особого рода пространственную изомерию. Появления этой изомерии следует ожидать в тех случаях, когда каждый из двух атомов углерода, соединенных двойной связью, находится в связи с двумя различными заместителями. В настоящее время можно считать доказанным, что во всех таких случаях действительно наблюдается особого рода стереоизомерия, названная цис-транс-изомерией или геометрической изомерией. Те изомеры, для которых предполагается конфигурация I, называются цис-изомерами (от латинского предлога cis, означающего «по эту сторону»); те же. для которых предполагается конфигурация II, называются транс-изомерами (trans — «по ту сторону»). Для конфигураций типа IБ и IIБ названия цис- или транс-изомеров могут быть применены только условно.
Случаи подобного рода изомерии этиленовых соединений были известны гораздо раньше, чем возникло изложенное выше представление о необходимости существования подобного рода цис-транс-стереоизомеров. Это представление, на возможность которого было указано еще Вант-Гоффом, было впоследствии подробно развито Вислиценусом.
Для простейшего из гомологов этилена, для которого должна иметь место геометрическая изомерия, а именно для псевдобутилена, имеющего строение симметрического диметилэтилена (2-бутена) СН3—СН=СН—СН3, эта изомерия была открыта в 1900 г. Вислиценусом. Углеводород такого строения был получен в двух формах, отличающихся как физическими свойствами, так и химическими реакциями. С характерными особенностями геометрической изомерии мы более подробно ознакомимся на примерах лучше исследованных одноосновных и двухосновных кислот этиленового ряда. Отсутствие свободного вращения вокруг двойной связи приводит к мысли о возможности интересного вида изомерии в случае производных аллена СН2=С=СН2.
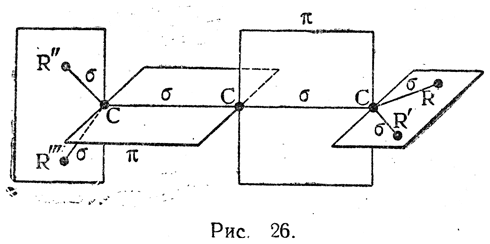
Схема связей в молекуле аллена (рис. 26) позволяет заключить, что при наличии различных заместителей R, R', R" и R"' или хотя бы при условии R≠R' и R"≠R"' молекула алленового производного должна существовать в виде двух энантиоморфных структур, отвечающих предмету и его зеркальному изображению, т. е. это будет случай оптической изомерии без асимметрического атома углерода (асимметрия всей молекулы в целом). Такую изомерию постулируют также и модели Вант-Гоффа (ср. рис. 27, I и II).
Однако попытки выделить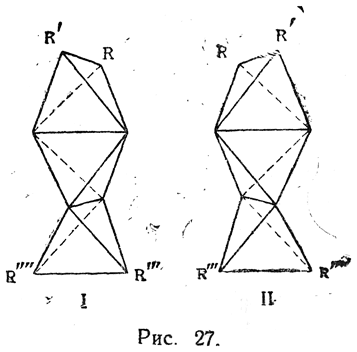 оптически деятельные аллены такого типа долго оставались безуспешными и удались лишь в 1935 г., когда Миллс и Мэйтланд в Англии получили оптически деятельные право- и левовращающие динафтилдифенилаллены
оптически деятельные аллены такого типа долго оставались безуспешными и удались лишь в 1935 г., когда Миллс и Мэйтланд в Англии получили оптически деятельные право- и левовращающие динафтилдифенилаллены
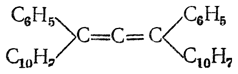
а Колер (США) расщепил на антиподы кислоту
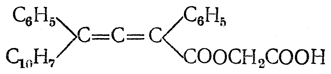
Позднее были получены оптически деятельные аллены, относящиеся не только к ароматическому, но и к жирному ряду. Модель тройной связи представляется по Вант-Гоффу в виде двух тетраэдров, сложенных основаниями и образующих одну трехгранную двойную пирамиду (рис. 28). Вследствие совершенно симметричного расположения обеих групп а и b возможность стереоизомерии здесь исключается. К тому же заключению приводит и рассмотрение комбинации σ-связи с двумя π-связями. В соответствии с этим, действительно, для ацетиленовых соединений известен только один вид изомерии — обусловленной изомерией радикалов, находящихся при атомах угле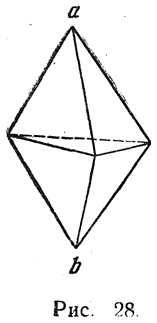 рода, связанных тройной связью.
рода, связанных тройной связью.


