Парциальные молярные величины
ПАРЦИАЛЬНЫЕ МОЛЯРНЫЕ ВЕЛИЧИНЫ, термодинамич. величины, к-рые используют для описания концентрац. зависимостей св-в р-ров. Пусть М -нек-рая экстенсивная ф-ция состояния системы из h компонентов, т. е. св-во, зависящее от массы системы (объем, внутр. энергия, энтальпия, энтропия, энергия Гиббса, энергия Гельмгольца, теплоемкость и т.п.). Для i-го компонента парциальная молярная величина Mi- определяется соотношением:
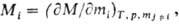
т.е. равна производной от величины M по числу молей mi компонента i при постоянных т-ре T, давлении p и числах молей 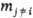 всех остальных компонентов. Так, парциальный молярный объем
всех остальных компонентов. Так, парциальный молярный объем
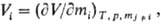
где V-объем системы; парциальная молярная энергия Гиббса (химический потенциал)
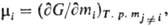
где G-энергия Гиббса системы.
Парциальная молярная величина характеризует изменение величины M при добавлении к бесконечно большому кол-ву р-ра 1 моля компонента i в условиях постоянства T, p и чисел молей всех остальных компонентов. Если молярная доля xi компонента равна единице, то парциальная молярная величина Mi обращается в молярную величину Mm для индивидуального в-ва (напр., парциальный молярный объем компонента - в молярный объем). Значение Mi определяется не только природой i-го компонента, но и св-вами системы в целом, поскольку молекулы i-го компонента взаимод. со всеми др. молекулами; в неявном виде эта величина учитывает все изменения св-в системы при внесении i-го компонента.
В реальном р-ре в общем случае все парциальные молярные величины зависят от состава, давления и т-ры. Если р-р идеальный, то при заданных Т и p парциальные молярные объем, внутр. энергия, энтальпия, теплоемкость во всей области концентраций постоянны и совпадают с соответствующими молярными величинами чистых компонентов. Хим. потенциал mi ид и парциальная молярная энтропия Si ид связаны с соответствующими молярными величинами чистого в-ва - энергией Гиббса 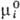 и энтропией
и энтропией 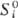 соотношениями:
соотношениями:
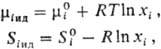
где R - газовая постоянная.
Зависимость парциальных молярных величин от Т и р определяется теми же термодинамич. соотношениями, что и для соответствующих экстенсивных св-в. Так, для хим. потенциала mi выполняются соотношения, аналогичные тем, к-рые справедливы для энергии Гиббса, а именно:
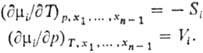
Ф-ция M для системы в целом представляет собой сумму парциальных молярных величин компонентов, умноженных на соответствующие числа молей: M = 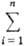 Mi mi. B частности, энергия Гиббса системы G =
Mi mi. B частности, энергия Гиббса системы G = 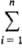 mimi. Молярное (удельное) значение Mm =
mimi. Молярное (удельное) значение Mm =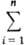 xiMi . Зависимости молярного значения Mm от T, р, x1 , ... , xn-1 служат для нахождения парциальных молярных величин:
xiMi . Зависимости молярного значения Mm от T, р, x1 , ... , xn-1 служат для нахождения парциальных молярных величин:
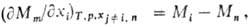
где
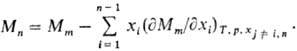
Для приближенного определения используют графич. метод (см. рис.). В случае бинарной системы
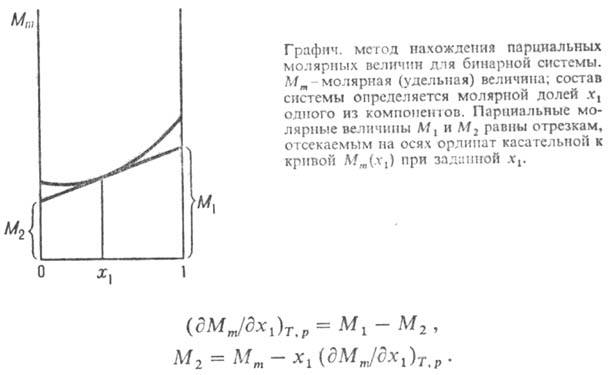
Изменения парциальных молярных величин при изменении состояния системы связаны между собой Гиббса-Дюгема уравнением, к-рое в обобщенном виде записывается след. образом:
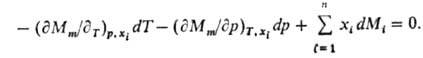
При Т, p = const (изотермо-изобарные условия)
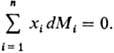
Согласно этому ур-нию, в бинарной системе парциальные молярные величины M1 и M2 при изменении состава изменяются в противоположных направлениях. Экстремумы на кривых M1(x1) и M2(x1), если таковые имеются, наблюдаются при одном и том же составе и противоположны по типу. Напр., для хим. потенциалов
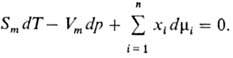 При T, p = const
При T, p = const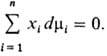
Это соотношение служит для расчета хим. потенциала компонента р-ра на основании концентрац. зависимости хим. потенциалов остальных компонентов, а также используется для проверки на термодинамич. согласованность эксперим. данных о зависимостях хим. потенциалов от состава, т-ры и т.п.
Понятие парциальных молярных величин широко используют при рассмотрении хим. и фазовых равновесий.
Лит.: Карапетьянц M. X., Химическая термодинамика, 3 изд., M., 1975; Физическая химия, под ред. Б. П. Никольского, 2 изд., Л., 1987. H. А. Смирнова.
