Рентгеноэлектронная спектроскопия
РЕНТГЕНОЭЛЕКТРОННАЯ СПЕКТРОСКОПИЯ (РЭС, ЭСХА-электронная спектроскопия для хим. анализа), метод исследования электронного строения хим. соед., состава и структуры пов-сти твердых тел, основанный на фотоэффекте с использованием рентгеновского излучения. При облучении в-ва происходит поглощение рентгеновского кванта hv (h-постоянная Планка, v-частота излучения), сопровождающееся эмиссией электрона (наз. фотоэлектроном) с внутренних или внешних оболочек атома. Энергия связи электрона Есв в образце в соответствии с законом сохранения энергии определяется ур-нием: Есв = hv-Eкин, где Eкин-кинетич. энергия фотоэлектрона. Значения Есв электронов внутр. оболочек специфичны для данного атома, поэтому по ним однозначно можно определить состав хим. соединения. Кроме того, эти величины отражают характер взаимод. исследуемого атома с др. атомами в соединении, т.е. зависят от характера хим. связи. Количеств. состав образца определяют по интенсивности I потока фотоэлектронов.
Принципиальная схема прибора для РЭС-электронного спектрометра-показана на рис. 1. Образцы облучают рентгеновским излучением из рейтгеновской трубки [обычно используют линии Кa (см. Рентгеновская спектроскопия)Аl или Mg с энергиями кванта hv соотв. 1486 и 1254 эВ] либо синхротронным излучением. Фотоэлектроны попадают в анализатор-прибор, в к-ром из общего потока выделяются электроны с определенной Екин. Сфокусир. монохроматич. поток электронов из анализатора направляется в детектор, где определяется его интенсивность I. В рентгеноэлектрон-ном спектре разным атомам соответствуют свои максимумы интенсивности (рис. 2), хотя нек-рые максимумы могут сливаться, давая одну полосу с увеличенной интенсивностью. Линии спектра обозначают след. образом: рядом с символом элемента называют исследуемую орбиталь (напр., запись Cls означает, что регистрируют фотоэлектроны с орби-тали 1s углерода).
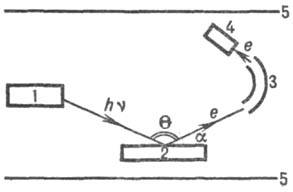
Рис. 1. Схема электронного спектрометра: 1-источник излучения; 2-образец; 3- анализатор; 4-детектор; 5-экран для · защиты* от магн. поля.
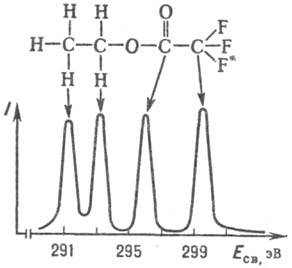
Рис. 2. Рентгеноэлектронный спектр Сls этилтри- фторацетата.
РЭС позволяет исследовать все элементы, кроме Н, при содержании их в образце ~ 10-5 г (пределы обнаружения элемента с помощью РЭС 10-7-10-9 г). Относит. содержание элемента может составлять доли процента. Образцы м. б. твердыми, жидкими или газообразными.
Величина Eсв электрона внутр. оболочки атома А в хим. соединениях зависит от эффективного заряда qА на этом атоме и электростатич. потенциала U, создаваемого всеми др. атомами соединения (т. наз. потенциала Маделунга): Eсв = kqА + U, где k-коэф. пропорциональности.
Для удобства в РЭС вводят понятие хим. сдвига DEсв, равного разности между Есв в исследуемом соед. и нек-ром стандарте. В качестве стандарта обычно используют значение Eсв, полученное для кристаллич. модификации элемента; напр., стандартом при исследовании соед. S служит кристаллич. сера. Поскольку для простого в-ва qА ! 0 и U = 0, то DEсв = kqA + U. Т. обр., положит. хим. сдвиг свидетельствует о положит. эффективном заряде на изучаемом атоме А в хим. соединении, а отрицательный-об отрицат. заряде, причем значения DEсв пропорционально эффективному заряду на атоме. Поскольку изменение эффективного заряда на атоме А зависит от его степени окисления, характера соседних атомов и геом. структуры соединения, по DEсв можно определять природу функц. групп, степень окисления атома, способ координации лйгандов и т.д.
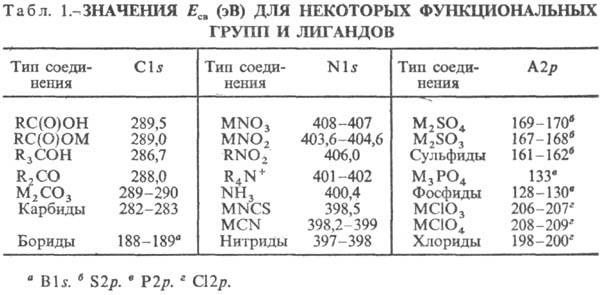
Энергии связи электронов функц. атомных групп слабо зависят от типа хим. соединения, в к-ром находится данная функц. группа. В табл. 1 приведены значения Eсв для ряда важнейших функц. групп и лйгандов. Относит. интенсивность максимумов, соответствующих разл. функц. группам или лигандам, пропорциональна числу таких групп в соединении. Напр., в Na2 [Fe(CN)5 NO] максимум Nls групп CN в пять раз интенсивнее максимума Nls группы NO, что м. б. использовано для определения числа разл. функц. групп (лйгандов).
Хим. сдвиг DEсв увеличивается с ростом степени окисления атома. Напр., Eсв электрона 4f платины в металлич. Pt, K2[PtCl4] и K2[PtCl6] составляет соотв. 71,3, 74,1 и 75,7 эВ. Для определения степени Окисления атома полезно след. эмпирич. правило: если лиганды в соед. с разными степенями окисления центр. атома одинаковы (напр., в К2 [PtCl4 ] и К2 [PtCl6 ], то с ростом его степени окисления на каждую единицу хим. сдвиг увеличивается примерно на 1 эВ.
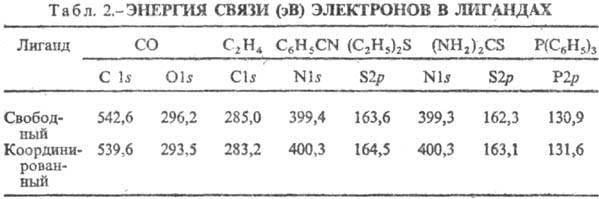
Увеличение (уменьшение) Eсв электронов внутр. оболочек соответствует уменьшению (увеличению) электронной плотности на рассматриваемом атоме. Так, в лигандах-донорах после координации следует ожидать повышения энергии связи электронов в атомах, участвующих в координации, поскольку донор отдает часть своей электронной плотности атому. В лигандах-акцепторах происходит перенос электронной плотности от центр. атома к атомам лиганда, вследствие чего Eсв должна уменьшаться. В качестве примера в табл. 2 приведены значения Eсв электронов в свободных и координированных лигандах (СО и С2Н4 - акцепторы, остальные лиганды-доноры). По таким данным можно определять атом лиганда, к-рый связан с центр. атомом.
Напр., из табл. 2 видно, что в случае (NH2 )2 CS координация идет через атом S, а не через N.
РЭС-один из осн. способов определения состава пов-сти, широко используется при изучении адсорбции, катализа, коррозии и т.д. Применение метода для этих целей основано на прямой зависимости интенсивности IА(i) линий i изучаемого атома А от его концентрации СА в поверхностном слое толщиной 2-3 нм, сопоставимой с длиной (l) своб. пробега электрона в в-ве: IА(i)=САsА(i)li. Величина sА(i)-сечение фотоионизации энергетич. уровня i, отражает вероятность ионизации атома А с этого уровня. Для энергетич. уровней i и j атомов А и В справедливо соотношение:
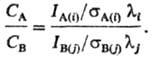
Величины sА(i), li, sB(j), lj- можно рассчитать теоретически и на основе измеренных значений IА(i) и IB(j) определить СА/СВ. Надежнее, однако, измерить величины IА(i)/IB(j) для неск. известных значений СА/СВ и экспериментально определить величину постоянного множителя (sА(i)li/sB(j)lj)= = const, а затем определить неизвестные отношения СА/СВ по измеренным значениям IА(i)/IB(j). Этот прием называют методом градуировочных кривых.
Для изучения распределения концентрации элементов по глубине образца необходимо проводить ионное травление, для чего применяют, напр., потоки ионов Аr+ и Кr+. За минуту с образца удаляется слой толщиной до неск. десятков нанометров. Через определенные промежутки времени проводят рентгеноэлектронный анализ пов-сти и получают зависимость интенсивностей. Ii от времени травления или от глубины, если известна скорость ионного травления. Таким образом можно проводить послойный анализ на глубину до неск. микрометров. Используя зависимость интенсивности I от угла a (рис. 1), можно определить изменение состава образца по глубине до 10 нм без его разрушения.
РЭС-единств. метод, позволяющий определить толщину d сверхтонких пленок (от 0,5 до 3,0 нм), а также сплошность покрытия (т.е. отсутствие пор). Метод основан на зависимости: IА(d) = IА(o)ехр(-d/lsina), где IА(d) и IА(o)-интенсивности линий элемента А соотв. с пленкой и без пленки; l-длина своб. пробега фотоэлектронов в пленке. Для расчета d достаточно измерить IА(d) при двух разл. значениях угла а.
Вследствие дифракции фотоэлектронов адсорбир. молекулы на атомах адсорбента-монокристалла интенсивность рентгеноэлектронного спектра зависит от углов между потоком фотоэлектронов и разл. направлениями в монокристалле. Эта зависимость позволяет определить способ координации адсорбир. молекулы.
Лит.: Миначев X. М., Автошин Г. В., Шпиро Е. С, Фотоэлектронная спектроскопия и ее применение в катализе, М., 1981; Нефедов В. И., Черепин В. Т., Физические методы исследования поверхности твердых тел, М., 1983; Немошкаленко В. В., Алешин В. Г., Электронная спектроскопия кристаллов, К., 1983; Нефедов В. И., Рештеноэлектронная спектроскопия химических соединений>_М., 1984. В. И. Нефедов.
