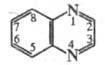
Хиноксалин
ХИНОКСАЛИН, мол. м. 130,15; бесцв. кристаллы; т. пл. 28 °С, т. кип. 220-223 °С, 108-111 оС/12 мм рт. ст.;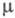 1,69 х 10-30 Кл х м; сравнительно сильное основание (рКа0,51). Хорошо раств. в воде и большинстве орг. р-рителей; с водой образует гидрат, т. пл. 37 оС.
1,69 х 10-30 Кл х м; сравнительно сильное основание (рКа0,51). Хорошо раств. в воде и большинстве орг. р-рителей; с водой образует гидрат, т. пл. 37 оС.
Хиноксалин-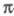 -дефицитное гетероароматич. соед. Легко вступает в р-ции нуклеоф. присоединения и восстановления, напр.:
-дефицитное гетероароматич. соед. Легко вступает в р-ции нуклеоф. присоединения и восстановления, напр.:
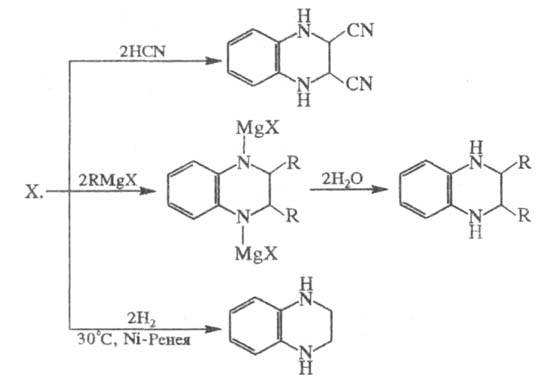
Электроф. замещение протекает по бензольному кольцу хиноксалина в жестких условиях, напр. нитрование смесью конц. HNO3 и олеума при 90 °С (в течение суток) приводит к образованию смеси 1,5% 5-нитро- и 24% 5,6-динитрохиноксалина.
Хиноксалин инертен к окислению HNO3 и К2Сr2О7, однако окисление КМnО4 в щелочном р-ре сопровождается расщеплением бензольного кольца с образованием 2,3-пиразиндикарбоновой к-ты, окисление персульфатом аммония дает 2,3-дигидроксихиноксалин (выход 30%).
Хиноксалин легко превращается в N-оксиды, напр. окисление 1 эквивалентом надуксусной к-ты приводит к 1-оксиду, избытком к-ты - к 1,4-диоксиду. Дальнейшее восстановит. хлорирование моно- или ди-N-оксидов хиноксалина действием РОС13 идет с образованием соотв. 2-хлор- и 2,3-дихлорпроизводных хиноксалина.
Получают хиноксалин конденсацией о-фенилендиамина с глиоксалем или его бисульфитным производным при 60 °С.
Хиноксалин - структурный фрагмент нек-рых прир. соед., напр. пептидного антибиотика эхиномицина. Нек-рые производные хиноксалина обладают противовес палит., антибактериальной (напр., сульфахиноксалин), анальгетич. и противомалярийной активностью.
Лит.: Гетероциклические соединения, под ред. Р. Эльдерфилда, пер. с англ., т. 6, М., 1960, с. 373-403; Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 160; Sakata G., Мakinо К., "Heterocycles", v. 27,1988, p. 2481.
P. А. Караханов, В. И. Келарев.
