Цезия оксид
ЦЕЗИЯ ОКСИД Cs2O, кристаллы (табл.), расплывающиеся на воздухе; в вакууме (10-3 Па) возгоняется при 350-450 °С, при 500 °С разлагается: 2Cs2O Cs2O2 + 2Cs; энергично реагирует с водой, давая CsOH, с влажным СО2, при 150-200 °С - с Н2, F2, C12, а также с расплавл. S; разлагается на свету; получают медленным окислением Cs кислородом (2/3 стехиометрич. кол-ва), остаток Cs отгоняют в вакууме при 180-200 °С. При окислении Cs кислородом получают также его пероксид и надпероксид.
Cs2O2 + 2Cs; энергично реагирует с водой, давая CsOH, с влажным СО2, при 150-200 °С - с Н2, F2, C12, а также с расплавл. S; разлагается на свету; получают медленным окислением Cs кислородом (2/3 стехиометрич. кол-ва), остаток Cs отгоняют в вакууме при 180-200 °С. При окислении Cs кислородом получают также его пероксид и надпероксид.
СВОЙСТВА ОКСИДА, ПЕРОКСИДА И НАДПЕРОКСНДА ЦЕЗИЯ
| Показатель | Cs2O | Cs2O2 | CsO2 | |
| Цвет | Коричнево-красный | Бледно-желтый | Золотисто -коричневый | |
| Сингония | Гексагон. | Ромбич. | Тетрагон. | |
| Параметры кристаллич. решетки, нм: а | 0,674 | 0,4322 | 0,4477 | |
| b | — | 0,7517 | — | |
| с | 1,882 | 0,6340 | 0,7350 | |
| Пространств. группа | 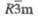 | Immm | 14/ттт | |
| Т. пл., °С | 595 | 594 | 130* | |
| Плотн., г/см3 | 4,36 | 4,47 (15 °С) | 3,76 (19 °С) | |
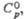 Дж/(моль x К) Дж/(моль x К) | 76,0 | 95,0 | 79,1 | |
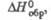 кДж/моль кДж/моль | -346,4 | -440 | -286 | |
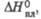 кДж/моль кДж/моль | 20 | 22 | — | |
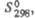 Дж/(моль x К) Дж/(моль x К) | 146,9 | 180 | 142 | |
*Т-ра полиморфного перехода, ниже -263,6 "Сив интервале от -263,6 до -83 oС существуют две ромбич. модификации.
Пероксид Cs2O2 - гигроскопичные кристаллы, выше 650 °С разлагается с выделением атомарного кислорода и активно окисляет Ni, Ag, Pt, Au; давление диссоциации 2261 Па (1103 °С); раств. в ледяной воде без разложения, выше 25 °С гидролизуется: 2Cs2O2 + 2Н2О 4CsOH + О2;
4CsOH + О2;
в к-тах раств. с образованием Н2О2; получают окислением Cs или его р-ра в жидком NH3 дозированным кол-вом О2.
Надпероксид CsO2 выше 350 °С диссоциирует с выделением О2, давление диссоциации 931 Па (400 С), 6783 Па (973 °С); очень сильный окислитель, окисляет, напр., ReO2 до Cs3ReO5, МnО2 - до Cs2MnO4, SeO2 - до Cs2SeO4; реагирует с Н2О, СО2, H2 с выделением О2; чистый CsO2 получают сжиганием металла в избытке О2, др. способы - окисление кислородом р-ра Cs в жидком NH4, амальгамы Cs, расплавов CsOH и Cs2O.
Цезия оксид - компонент сложных фотокатодов, спец. стекол и катализаторов; Cs2O2, CsO2 - источники О2 и его регенераторы в космич. и подводных кораблях.
Л. И. Покровская.
