Натрия перхлорат
НАТРИЯ ПЕРХЛОРАТ NaClO4, бесцв. кристаллы; до 306 °С устойчива ромбич. модификация - фаза I (а = 0,7085 нм, b = 0,6526, с = 0,7048, пространствю группа D2h17, плотн. 2,495 г/см3), выше 306°С-кубич. фаза IV (при 315 °С а = 0,708 нм; пространств. группа О5h); DH перехода I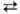 IV 1,30 кДж/моль. Существуют две фазы натрия перхлората высокого давления - фаза II со структурой типа AgMnO4, устойчивая при давлении 2,3-3,0 ГПа, и фаза III со структурой барита, устойчивая при давлении выше 3,0 ГПа. Для натрия перхлората т. пл. 469 °С (с разл.); С0р 110,3 Дж/(моль.К); DH0обр -383,5 кДж/моль; S0298 143,9 Дж/(моль.К). Медленный распад натрия перхлората начинается вблизи т-ры плавления, быстрый-в интервале 490-600 °С, продукты распада-NaCl и О2. Добавки Со3О4, MnO2, Na2O2 и др. оксидов понижают т-ру разложения натрия перхлората на 150-200°С.
IV 1,30 кДж/моль. Существуют две фазы натрия перхлората высокого давления - фаза II со структурой типа AgMnO4, устойчивая при давлении 2,3-3,0 ГПа, и фаза III со структурой барита, устойчивая при давлении выше 3,0 ГПа. Для натрия перхлората т. пл. 469 °С (с разл.); С0р 110,3 Дж/(моль.К); DH0обр -383,5 кДж/моль; S0298 143,9 Дж/(моль.К). Медленный распад натрия перхлората начинается вблизи т-ры плавления, быстрый-в интервале 490-600 °С, продукты распада-NaCl и О2. Добавки Со3О4, MnO2, Na2O2 и др. оксидов понижают т-ру разложения натрия перхлората на 150-200°С.
Р-римость натрия перхлората при 25°С (г в 100 г р-рителя): в воде-209,6, метаноле-51,3, этаноле-14,7, ацетоне-51,7, этилаце-тате-9,65. Из водного р-ра выше 52 °С кристаллизуется безводный натрия перхлорат, в интервале от 52 до — 13 °С - моногидрат, от —13 до -39°С-дигидрат; в интервале от 0 до 52 °С ур-ние температурной зависимости давления диссоциации моногидрата lgр(мм рт.ст.) = 10,51 -2906/T. Натрия перхлорат образует сольваты NaClO4.nL, где n=1 (L-N2H4; гексаметил-фосфотриамид, т. пл. сольвата 174°С), 4(NH3); 2 (метил-формамид, т. пл. сольвата 45 °С), 3 (диоксан). Сольваты натрия перхлората с орг. в-вами взрывоопасны. Т-ра эвтектики в системе NaClO4-LiClO4 208°С (27,5 мол. % натрия перхлората), NaClO4-NaOH 243°С (15 мол. % натрия перхлората), NaClO4-NaCl 417°С (85 мол. % натрия перхлората). С перхлоратами Al, Zn, Cd и др. натрия перхлорат образует комплексные перхлоратометаллаты, напр. Na2[Al(ClO4)5], Na[Zn(ClO4)3], Na[Cd2(ClO4)5].
Получают натрия перхлорат электролизом водного р-ра NaClO3 или NaCl с анодом из Pt или РbО2, нанесенных на графит, при 30-60°С и плотн. тока 15-52 А/дм2. Натрия перхлорат-исходный продукт в произ-ве NH4ClO4, компонент смесевых ВВ, пиро-техн. составов, напр. пиротехн. источников О2.
Лит.: Шумахер И., Перхлораты. Свойства, производство и применение, пер. с англ., М., 1963.
В. Я. Росоловский.
