Хорионический гонадотропин
ХОРИОНИЧЕСКИЙ ГОНАДОТРОПИН (ХГ, хориогонадотропин), белковый гормон приматов.ХГ - гликопротеин (мол. м. ок. 38 тыс.), молекула к-рого состоит из двух разл. субъединиц (
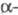 ХГ и
ХГ и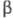 -ХГ), нековалентно связанных друг с другом. Молекулы ХГ человека и разных видов животных, обладая значит. гомологией, совпадают не полностью.
-ХГ), нековалентно связанных друг с другом. Молекулы ХГ человека и разных видов животных, обладая значит. гомологией, совпадают не полностью. Субъединица
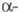 ХГ идентична
ХГ идентична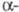 субъединице лютеинизирующего гормона, фолликулостимулирующего гормона, а также тиреотропного гормона и включает 92 аминокислотных остатка.
субъединице лютеинизирующего гормона, фолликулостимулирующего гормона, а также тиреотропного гормона и включает 92 аминокислотных остатка.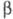 -ХГ, полипептидная цепь к-рой состоит из 145 аминокислотных остатков, специфична для данного гормона, но проявляет высокую степень структурной гомологии (ок. 80%) с
-ХГ, полипептидная цепь к-рой состоит из 145 аминокислотных остатков, специфична для данного гормона, но проявляет высокую степень структурной гомологии (ок. 80%) с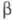 -субъединицей лютеинизирующего гормона, отличаясь от последней удлинением С-концевого участка полипептидной цепи на 24 аминокислотных остатка.
-субъединицей лютеинизирующего гормона, отличаясь от последней удлинением С-концевого участка полипептидной цепи на 24 аминокислотных остатка. На углеводную часть, характеризующуюся значит. гетерогенностью, приходится ок. 30% мол.м. ХГ. В ее состав входят сиаловая к-та, L-фукоза, D-галактоза, D-манноза, N-ацетилглюкозамин и N-ацетилгалактозамин.
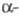 ХГ содержит две олигосахаридные цепи, присоединенные к полипептидной цепи с помощью N-гликозидной связи между N-ацетилглюкозамином и амидной группой двух остатков аспарагина.
ХГ содержит две олигосахаридные цепи, присоединенные к полипептидной цепи с помощью N-гликозидной связи между N-ацетилглюкозамином и амидной группой двух остатков аспарагина.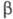 -ХГ содержит 6 олигосахаридных цепей, 2 из к-рых присоединены N-гликозидной связью по остаткам аспарагина, а 4 -О-гликозидной связью между остатками N-ацетилгалактозамина и группой ОН остатков серина С-концевого участка полипептидной цепи. Углеводные компоненты ХГ необходимы для соединения субъединиц, поддержания конформации его молекулы, защищают полипептидные цепи субъединиц от расщепления протеолитическими ферментами. Удаление углеводных остатков приводит к значит. уменьшению периода полужизни ХГ в организме.
-ХГ содержит 6 олигосахаридных цепей, 2 из к-рых присоединены N-гликозидной связью по остаткам аспарагина, а 4 -О-гликозидной связью между остатками N-ацетилгалактозамина и группой ОН остатков серина С-концевого участка полипептидной цепи. Углеводные компоненты ХГ необходимы для соединения субъединиц, поддержания конформации его молекулы, защищают полипептидные цепи субъединиц от расщепления протеолитическими ферментами. Удаление углеводных остатков приводит к значит. уменьшению периода полужизни ХГ в организме. Молекула ХГ сравнительно легко диссоциирует на субъединицы, напр. при действии мочевины или пропионовой к-ты. Изолир.
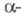 ХГ и
ХГ и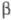 -ХГ лишены биол. активности, но могут рекомбинировать с образованием биологически активной молекулы ХГ.
-ХГ лишены биол. активности, но могут рекомбинировать с образованием биологически активной молекулы ХГ. Специфич. биол. св-ва ХГ обусловлены
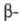 субъединицей. Структурное сходство, имеющееся между
субъединицей. Структурное сходство, имеющееся между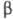 -субъединицами ХГ и лютеинизирующего гормона, проявляется близостью их биол. и иммунологич. св-в.
-субъединицами ХГ и лютеинизирующего гормона, проявляется близостью их биол. и иммунологич. св-в. ХГ вырабатывается при беременности клетками трофобласта (наружный слой клеток у зародышей млекопитающих) плаценты. Может также вырабатываться нек-рыми опухолями, родственными по происхождению клеткам трофооласта плаценты.
В процессе биосинтеза ХГ вначале на отдельных матричных РНК синтезируется полипептидная цепь каждой из субъединиц в виде соответствующих молекул-предшественников с более высокой мол. массой. Синтез и присоединение олигосахаридных цепей происходят в процессе трансляции субъединиц и после ее завершения. Зрелые полипептидные цепи ХГ образуются путем специфич. протеолитич. модифицирования (укорочения) белков-предшественников. Субъединицы объединяются в одну молекулу в грубом эндоплазматич. ретикулуме.
Физиол. роль ХГ состоит в поддержании нормального развития беременности. ХГ стимулирует продуцирование желтым телом, образующимся в яичниках при беременности, стероидных гормонов прогестерона и эстрогенов, что является необходимым условием для сохранения беременности. Кроме того, ХГ участвует в регуляции др. процессов, связанных с нормальным протеканием беременности, в т. ч. препятствует отторжению зародыша в материнском организме, влияя на иммунные процессы. При введении ХГ в организм человека или животных наблюдается эффект, аналогичный действию лютеинизирующего гормона. У небеременных женщин ХГ вызывает овуляцию в созревших фолликулах и образование желтых тел в яичниках. У мужчин ХГ стимулирует секрецию тестостерона половыми железами.
Секреция ХГ максимальна в раннем периоде беременности. Определение ХГ в крови или моче - основа теста на ее наличие.
ХГ выделяют из плаценты человека и животных. Препараты ХГ для мед. применения получают из мочи беременных женщин. ХГ используют при понижении ф-ции половых желез у мужчин и женщин, при бесплодии, позднем половом развитии и др.
Лит.: Димитров Д. Я., Хориальный гонадотропин человека,пер. с болт., М., 1979; Физиология эндокринной системы, Л., 1979, с. 399; Pierce J. G., Parsons Т.F., "Ann. Rev. Biochem.", 1981, v. 50, p. 465-95; Fiddes J.C., Talmadge K., "Recent Prog. Horm. Res.", 1984, v. 4, p. 43-78; Lustbader J. [a. o.], "J. Biol. Chem.", 1987, v. 262, № 29, p. 4204-12. А. А. Булатов.
Синонимы/примеры:*
Хориогонин; Прегнил; Профази; Хорагон; Хориомон
*подобраны ИИ, возможны неточности
Ещё по теме
Хорионический гонадотропин — функции и применение
Гонадотропин хорионический — свойства и применение
Гонадотропные гормоны — функции и структура
Гонадолиберин — функции и применение в медицине
Гонадотропины и их роль в медицине
Гидрофильные гормоны и их роль в организме
Гестагены — функции и применение
Гормоны — строение, механизм действия и применение
Женские половые гормоны — эстрогены и прогестерон
Гонадотропные гормоны — что это и как они работают?
Структура и функции хроматина
Гемоглобин — строение, функции и роль в организме
Гормоны — определение и роль в организмах
Роль половых гормонов в организме человека
Половые гормоны — функции и влияние на организм
Лютеинизирующий гормон — строение и функции
Гормоны и их роль в организме
