Вревского законы
ВРЕВСКОГО ЗАКОНЫ, описывают зависимость состава равновесных жидкой и паровой фаз двойных систем от т-ры (давления). Основываются на общих термодинамич. соотношениях, устанавливающих условия равновесия в двухфазных системах, частным случаем к-рых является равновесие жидкость - пар. При выводе Вревского законов сделан ряд допущений, в частности предполагается, что поведение газовой фазы близко к поведению идеального газа. Поэтому Вревского законы справедливы только для области т-р и давлений, значительно удаленной от критич. точки равновесия жидкость - пар в данной системе.
Первый Вревского закон: при данном составе жидкой фазы равновесная с ней газовая фаза с увеличением т-ры (давления) обогащается тем компонентом, для к-рого больше парциальная мольная теплота испарения. Приближенно вместо парциальной мольной теплоты испарения данного компонента можно использовать теплоту испарения чистого в-ва. Второй Вревского закон: в азеотропной смеси с максимумом на изотерме зависимости общего давления от состава (минимумом на изобаре т-р кипения) при повышении т-ры (давления) возрастает концентрация компонента с большей парциальной мольной теплотой испарения. В азеотропной смеси с минимумом общего давления (максимумом т-ры кипения) при повышении т-ры (давления) возрастает концентрация компонента с меньшей парциальной мольной теплотой испарения. Этот закон особенно важен при разработке процессов азеотропной ректификации.
Третий Вревского закон: при изменении т-ры в системах, для к-рых на кривой зависимости общего давления от состава имеется максимум (на кривой т-р кипения — минимум), состав пара, находящегося в равновесии с р-ром постоянного состава, и состав азеотропной смеси изменяются в одном направлении (вдоль линий АВ и LM на рис. а); если же кривая общего давления имеет минимум (кривая т-р кипения - максимум), то при изменении т-ры состав пара, находящегося в равновесии с р-ром постоянного состава, и состав азеотропной смеси изменяются в противоположных направлениях (вдоль линий АВ и LM на рис. б).
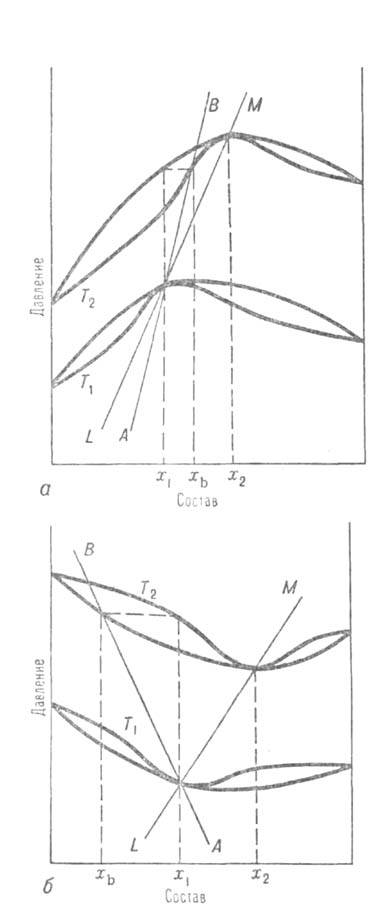
Диаграмма равновесия жидкость - пар для двойных систем с положит. (а) и отрицат. (б) азеотропами; Т1 и Т2 - т-ры, х1 и х2 -составы, соответствующие азеотропным смесям, xb- состав пара при Т2, равновесного жилкой смеси состава x1. Линия AВ-изменение состава пара с т-рой, линия LM - изменен не состава азеотропа с т-рой.
Законы были сформулированы М.С. Вревским в 1911 на основе эксперим. исследований и широко используются при разработке процессов разделения жидких смесей и очистки в-в.
Литература
Вревский М.С, Работы по теории растворов. М.-Л., 1953; Коган В. Б., Гетерогенные равновесия, Л., 1968, с. 114-26; Хазанова Н. Е., Системы с азеотропизмом при высоких давлениях, М., 1978. Н. Е. Хазанова.
