Значение галоидзамещенных кислот для стереохимических исследований
Высшие гомологи α-галоидзамещенных нормальных одноосновных кислот
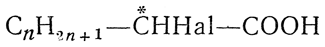
начиная с α-галоидпропионовых кислот, например
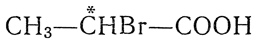
, а также многие другие одно- и двухосновные галоидкислоты, например монохлорянтарная кислота НООС—СН2—*СНСl—СООН, содержат один асимметрический атом углерода. Поэтому они должны существовать в двух оптически деятельных формах, вращающих в противоположные стороны (d- и l-формы), и в одной оптически недеятельной форме (i-, или r-форма), представляющей собой смесь или рацемическое соединение двух оптических антиподов.
Обозначения d- и l- происходят от латинских прилагательных dextrogyrus — правовращающий и laevogyrus — левовращающий; i- от inactivus — неактивный (оптически), r- от racemicus — рацемический. Вместо обозначения i-форма часто встречается обозначение d,l-форма. В последнее время для обозначения правого вращения все чаще применяют знак (+), а для левого — знак (—).
Для передачи пространственного строения (конфигурации) этих антиподов галоидзамещенных кислот можно пользоваться следующими тремя системами написания формул:
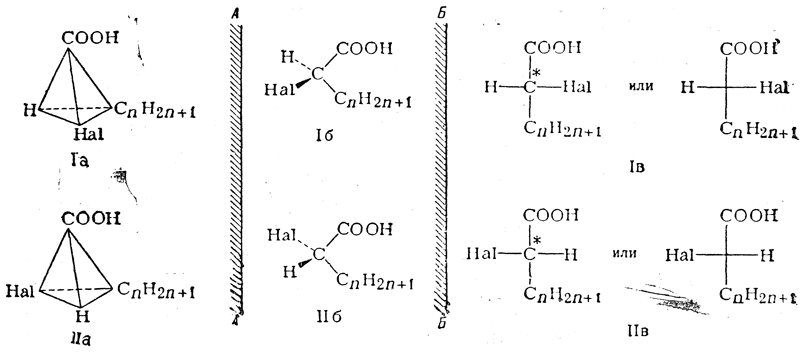
Перспективные формулы Iа, Iб, IIа и IIб показывают, как расположены в пространстве все четыре заместителя при асимметрическом центре молекулы. Однако подобные формулы труднее писать, и поэтому вместо них обычно пользуются более простыми формулами Iв и IIв, которые предложены Э. Фишером. Такие формулы показывают, как выглядит молекула в проекции на плоскость, и поэтому их называют проекционными формулами. Во всех проекционных формулах вертикальные линии изображают те связи, которые направлены от асимметрического атома за плоскость чертежа (в формулах Iв и IIв связи
 и
и 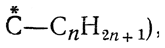 , а горизонтальные линии соответствуют связям, выходящим из плоскости чертежа к наблюдателю (в формулах Iв и IIв связи
, а горизонтальные линии соответствуют связям, выходящим из плоскости чертежа к наблюдателю (в формулах Iв и IIв связи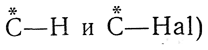 . Таким образом, для того чтобы построить проекционные формулы Iв и IIв, нужно смотреть на формулы Iб и IIб слева и проецировать их на плоскость Б—Б, перпендикулярную плоскости чертежа; если же смотреть на формулы Iб и IIб справа и проецировать их на плоскость А—А, также перпендикулярную плоскости чертежа, то это приведет к проекционным формулам оптически антиподных веществ.
. Таким образом, для того чтобы построить проекционные формулы Iв и IIв, нужно смотреть на формулы Iб и IIб слева и проецировать их на плоскость Б—Б, перпендикулярную плоскости чертежа; если же смотреть на формулы Iб и IIб справа и проецировать их на плоскость А—А, также перпендикулярную плоскости чертежа, то это приведет к проекционным формулам оптически антиподных веществ.
Раньше не было возможности установить, какова в действительности конфигурация того или иного вещества. Например, для двух антиподных форм α-хлорянтарной кислоты
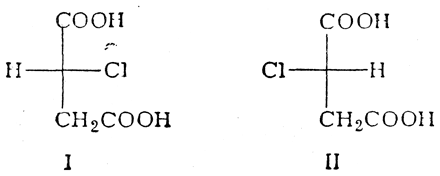
нельзя было сказать, какая из них имеет строение I и какая — строение II. Такое же положение складывалось и в отношении других оптически деятельных соединений (оксиальдегидов, оксикислот, аминокислот и т. д.), хотя было известно, что многие из этих соединений аналогичны друг другу по конфигурации: например, что d-глицериновый альдегид аналогичен l-молочной кислоте и d-яблочной кислоте. Чтобы обойти трудности, связанные с этой неопределенностью, было условно принято изображать d-глицериновый альдегид приведенной ниже формулой, а все стереохимически родственные ему вещества относить к ряду D-соединений (D)-ряд), например:
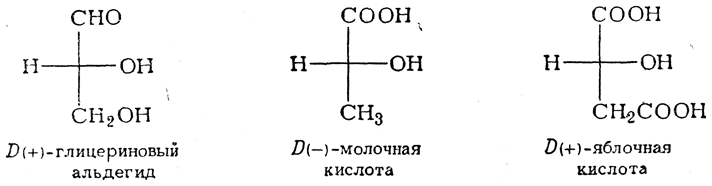
Оптическим антиподам этих веществ стали придавать зеркально-изомерные формулы и называть их L-соединениями (L-ряд).
Как было установлено в дальнейшем, эта произвольно выбранная формула (+ -глицеринового альдегида оказалась правильно отражающей его действительную конфигурацию. Следовательно, все основанные на ней проекционные формулы других оптически деятельных соединений также являются совершенно правильными.
Можно было бы ожидать, что при замене на галоид гидроксила в природных оптически деятельных оксикислотах, например в молочной или яблочной, будут образовываться оптически деятельные галоидзамещенные кислоты. Однако практически осуществить такой переход долгое время не удавалось, и лишь в 1895 г. Вальден впервые смог получить эти соединения осторожным действием галогенидов фосфора на оптически деятельные оксикислоты. Неудачи предыдущих исследований объясняются тем, что оптически деятельные галоидкислоты (особенно неочищенные препараты) легко превращаются в соответствующие оптически недеятельные соединения.
Такое превращение оптически деятельных соединений в оптически не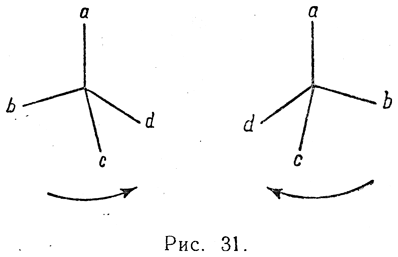 деятельные, называемое
деятельные, называемое
рацемизацией, является результатом обмена местами каких-либо двух атомов или радикалов, связанных с асимметрическим атомом углерода (например, заместителей b и d на рис. 31). Какова бы ни была причина такого обмена местами радикалов, эта реакция вследствие полной равноценности обеих конфигураций должна быть обратимой и протекать для обоих оптических изомеров с одинаковой скоростью. Следовательно, равновесие будет достигаться при равной концентрации молекул обоего рода, т. е. при получении оптически недеятельной смеси изомеров (рацемическая смесь).
Исследование различных оптических изомеров показало, что рацемизации с большей или меньшей легкостью подвергаются многие оптически деятельные соединения, относящиеся не только к галоидкислотам, но и к другим классам органических веществ.
При исследовании реакций обмена, ведущих к получению оптически деятельных галоидкислот и к замене в них галоида на гидроксил или другие группы, Вальденом было сделано в высшей степени важное открытие. Им было, например, обнаружено, что в зависимости от реагента и условий реакции из (+)-хлорянтарной кислоты получаются как (—)-, так и (+)-яблочные кислоты, причем последняя с РСl5 образует (—)-хлорянтарную кислоту, благодаря чему можно осуществить следующий круговой процесс:
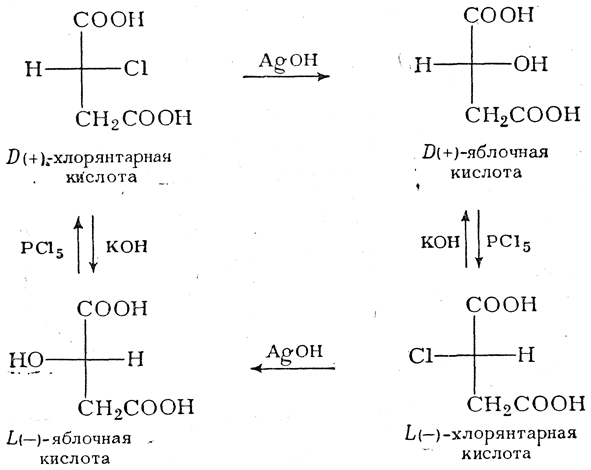
Такое превращение оптически деятельного вещества в его антипод (D- в L- или наоборот) свидетельствует о том, что при одной из реакций обмена (в данном случае — при действии РСl5 и КОН) вступивший атом (или группа) занимает не то положение в пространстве, которое раньше занимал отщепившийся в процессе реакции атом (или группа), т. е. произошла изменение конфигурации молекулы. Это явление, получившее название вальденовского обращения, имеет принципиальное значение для всей стереохимии органических соединений и будет рассмотрено подробнее на стр. 593 сл.


