Метаболизм липидов
Печень является главным местом синтеза жирных кислот, жиров, кетоновых тел и холестерина. Жиры могут также синтезироваться в жировой ткани, однако ее основной функцией остается депонирование липидов.
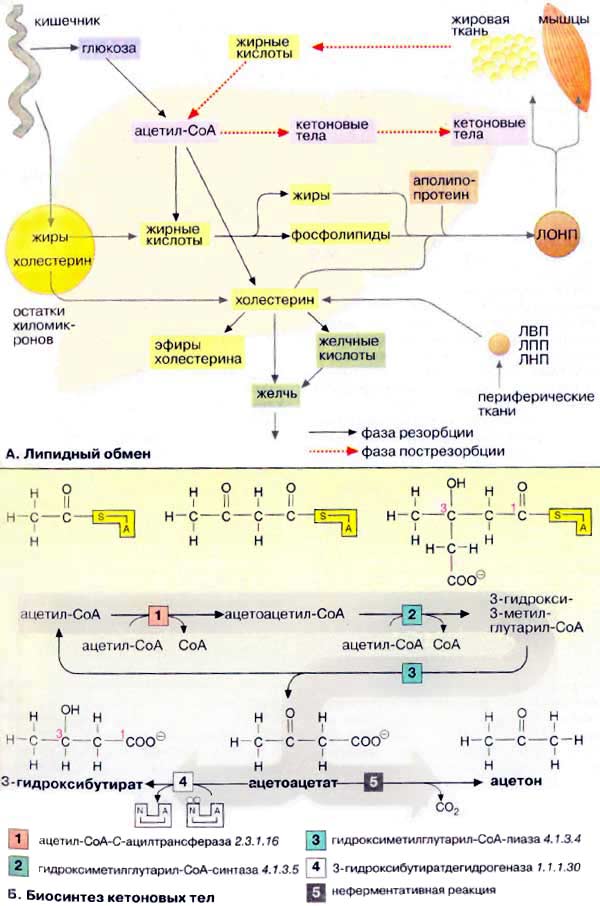
Обмен липидов в печени тесно связан с превращением углеводов и аминокислот. При поступлении питательных веществ в фазе резорбции глюкоза через промежуточное образование ацетил-КоА (ацетил-СоА) конвертируется в жирные кислоты. Печень может также извлекать жирные кислоты из липопротеинов, поступающих из желудочно-кишечного тракта (в виде хиломикронов) и других тканей (см. с. 272). Жирные кислоты используются для биосинтеза триглицеринов и фосфолипидов. При связывании жиров с аполипопротеинами образуются липопротеиновые комплексы очень низкой плотности [ЛОНП (VLDL), см. с. 272]. Они попадают в кровь и переносятся в другие ткани, прежде всего в жировую и мышечную ткань.
В фазе пострезорбции, особенно в период поста или голодания, обмен липидов идет в обратном направлении, организм обращается к собственным запасам. В этих условиях жиры поступают из жировой ткани в кровь, переносятся в печень, распадаются в результате β-окисления до ацетил-КоА и, наконец, превращаются в кетоновые тела.
Холестерин поступает в организм из двух источников — с пищей и за счет эндогенного синтеза, причем большая часть холестерина синтезируется в печени. Биосинтез холестерина начинается с ацетил-КоА. Полученный холестерин используется в синтезе желчных кислот, встраивается в клеточные мембраны, депонируется в жировых каплях в составе эфиров жирных кислот. Остальная часть поступает в кровь в составе липопротеиновых комплексов [ЛОНП (VLDL)] и переносится в другие ткани. Печень способствует обмену холестерина благодаря тому, что служит местом, худа поступают с кровью и где подвергаются расщеплению липопротеиновые комплексы [ЛВП, ЛПП, ЛНН (HDL, IDL, LDL), см. с. 272], содержащие холестерин и его эфиры с жирными кислотами.
Б. Биосинтез кетоновых тел
При высокой концентрации ацетил-КоА в митохондриях гепатоцитов происходит конденсация двух молекул ацетил-КоА с образованием ацетоацетил-КоА [1]. Присоединение еще одной ацетильной группы [2] приводит к 3-гидрокси-З-метилглутарил-КоА (ГМГ-КоА) [3], который после отщепления ацетил-КоА превращается в ацетоуксусную кислоту (ацетоацетат) (цикл Линена). При восстановлении последней получается 3-гидроксибутират [4], а при неферментативном декарбоксилировании — ацетон [5]. Все три соединения принято называть «кетоновыми телами», что не совсем правильно, поскольку в 3-гидроксимасляной кислоте отсутствует кетогруппа!
Кетоновые тела поступают из печени в кровь, где они хорошо растворимы. Концентрация кетоновых тел в крови возрастает в фазе пострезорбции (фаза голодания). Наряду с жирными кислотами 3-гидроксибутират и ацетоацетат в этот период являются основными энергоносителями. Ацетон, не имеющий метаболической ценности, удаляется через легкие. После 1-2 недели голодания кетоновые тела начинают использоваться в качестве источника энергии нервными тканями. Однако при этом для обеспечения цитратного цикла необходимо минимальное количество глюкозы.
Если биосинтез кетоновых тел превышает потребности организма, они накапливаются в крови (кетонемия) и, наконец, выводятся с мочой (кетонурия). Оба феномена наблюдаются во время длительного голодания (углеводная недостаточность) и при заболеваний диабетом (Diabetes mellitis). Хотя 3-гидроксимасляная кислота является слабой кислотой (рКа примерно 4), возрастание концентрации кетоновых тел вызывает изменение рН в крови (кетоацидоз, см. с. 280). Кетонурия и кетоацидоз могут быстро привести к электролитному сдвигу (нарушению ионного гомеостаза) и потери сознания (кетоацидозной коме) и, следовательно, опасны для жизни.


