Метаболизм углеводов
Глюкоза, наряду с жирными кислотами и кетоновыми тепами, является важнейшим источников энергии. Уровень глюкозы в крови поддерживается постоянным 4-6 мМ (0,8-1,0 г/л) благодаря тонкой регуляции процессов ее поступления и потребления. Глюкоза поступает из кишечника (за счет переваривания пищи), печени и почек. При этом печень выполняет функцию «глюкостата»: в фазе резорбции глюкоза поступает в печень из крови и накапливается в виде гликогена. При дефиците глюкозы (фаза пострезорбции, голодание) печень, напротив, поставляет глюкозу, которая образуется за счет процессов гликогенолиза и глюконеогенеза.
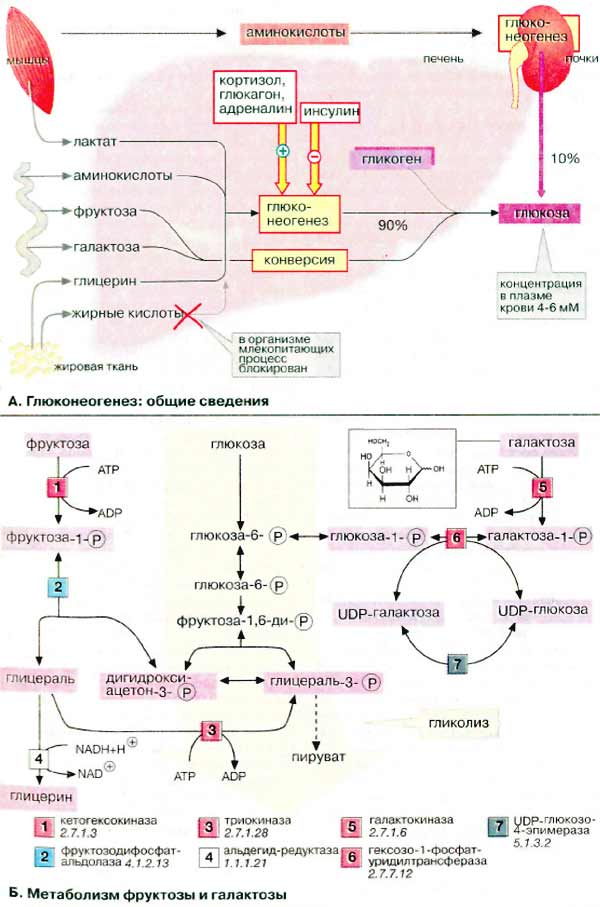
Печень обладает свойством синтезировать глюкозу из других сахаров, например фруктозы и галактозы, или из других продуктов промежуточного метаболизма. Превращение лактата в глюкозу в цикле Кори и аланина в глюкозу в цикле аланина (см. с. 330) играет особую роль в обеспечении эритроцитов и мышечных клеток.
Необходимыми условиями активного углеводного обмена в печени является обратимый транспорт сахаров через плазматическую мембрану гепатоцитов (при отсутствии контроля инсулином) и наличие фермента глюкозо-6-фосфатазы, высвобождающего глюкозу из глюкозо-6-фосфата.
А. Глюконеогенез: общие сведения
Синтез глюкозы de novo (до 250 г в сутки) происходит в основном в печени. Процесс глюконеогенеза может идти и в почках, однако из-за небольших размеров почек их вклад в синтез глюкозы составляет всего 10%.
Глюконеогенез контролируется гормонами. Кортизол, глюкагон и адреналин стимулируют этот процесс, а инсулин, напротив, подавляет.
При глюконеогенезе в печени наиболее важными субстратами являются лактат, поступающий из мышечной ткани и эритроцитов, аминокислоты из желудочно-кишечного тракта (глюкогенные аминокислоты) и мышц (аланин), а также глицерин из жировых тканей. В почках в качестве субстрата служат главным образом аминокислоты (см. с. 320).
Жирные кислоты и другие источники ацетил-КоА не могут использоваться в организме млекопитающих для биосинтеза глюкозы, поскольку ацетил-КоА, образующийся при β-окислении в цитратном цикле, полностью окисляется до СО2, в то время как в глюконеогенезе исходным продуктом является оксалоцетат.
Б. Метаболизм фруктозы и галактозы
Метаболизм фруктозы осуществляется превращением ее в глюкозу (на схеме слева). Вначале фруктоза фосфорилируется при участии фермента кетогексокиназы (фруктокиназы) [1] с образованием фруктозо-1-фосфата, который далее расщепляется альдолазой до глицеральдегида (глицераля) и дигидроксиацетон-3-фосфата [2]. Последний уже является промежуточным продуктом гликолиза (в центре схемы), а глицераль фосфорилируется в присутствии триокиназы, образуя глицераль-3-фосфат [3].
Затем глицеральдегид частично восстанавливается до глицерина [4] или окисляется до глицерата. После фосфорилирования оба соединения вновь включаются в гликолиз (на схеме не приведено). При восстановлении глицеральдегида [4]расходуется НАДН (NADH). Поскольку при конверсии этанола лимитирующим фактором является низкое соотношение концентраций НАД+/НАДН (NAD+/NADH). Этот процесс ускоряется в присутствии фруктозы.
Кроме того, в печени реализуется полиольный путь трансформации фруктозы в глюкозу (на схеме не приведен): фруктоза за счет восстановления С-2 превращается в сорбит, а при последующем дегидрировании С-1 — в глюкозу.
Метаболизм галактозы также начинается с фосфорилирования с образованием галактозо-1-фосфата [5] (на схеме справа). Далее следует эпимеризация С-4 с образованием производного глюкозы. Биосинтез УДФ-глюкозы (UDP-глюкозы), промежуточного продукта обмена глюкозы, осуществляется обходным путем — через УДФ-галактозу (UDP-галактозу) и последующую эпимеризацию [6, 7]. По такому же пути идет биосинтез самой галактозы, поскольку все реакции за исключением [5] обратимы.


