Дёбнера-Миллера реакция
ДЁБНЕРА-МИЛЛЕРА РЕАКЦИЯ, получение замещенных хинолина циклоконденсацией ароматич. аминов, у к-рых свободно орто-положение, с альдегидами или кетонами. 2,3-Дизамещенные хинолина получают с хорошим выходом по схеме: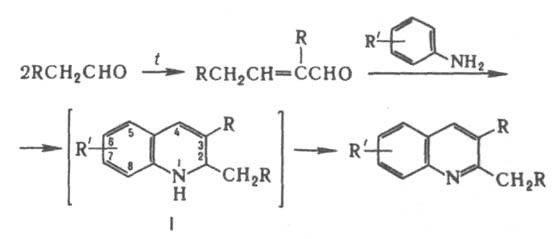
Первая стадия - кротоновая конденсация, к-рую осуществляют в присут. ZnCl2, а также соляной к-ты или H2SO4. Дегидрирование промежут. соед. I происходит под действием азометинов, образующихся при взаимод. исходного амина с альдегидом. Существуют и др. взгляды на механизм р-ции. Использование двух разл. альдегидов также приводит к 2,3-дизамещенным хинолина. Для получения 2,4-дизамещенных хинолина в р-ции используют пировиноградную к-ту:
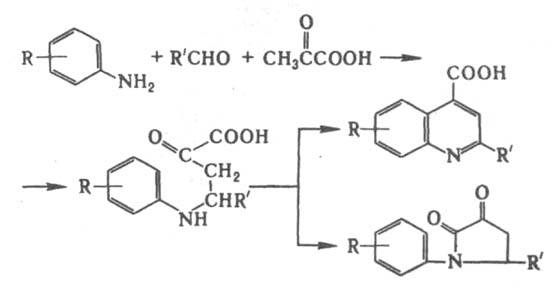
Из ароматич. альдегидов (R'-арил) образуются гл. обр. производные хинолина, из алифатических (R'- алкил) - пирролидоны, Р-ция открыта О. Дёбнером и В. Миллером в 1881. Модификация Бейера - получение 2,4-дизамещенных хинолинов взаимод. смеси альдегида и метилкетона с ароматич. амином:
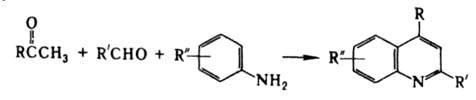
Предложена К. Бейером в 1886. Исп. литература: Гетероциклические соединения, пер. с англ., т. 4, М., 1955, с. 13-14, 20-23; Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 201-203. Г. В. Гришина.
*Подобраны с помощью LLM, верифицированы, но возможны неточности.
Ещё по теме
Фридлендера синтез — получение производных хинолина
Реакции Пиннера и Линкера в органической химии
Реакции Циглера в органической химии
Розенмунда реакция — метод получения альдегидов
Реакция Розенмунда — особенности и применение
Шимана реакция — особенности и применение
Фишера реакция — ключевые аспекты и примеры

Дополнения к описанию реакции Дёбнера-Миллера: