Дифенилсульфон
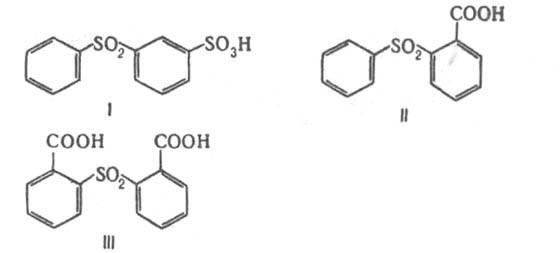
ДИФЕНИЛСУЛЬФОН (фенилсульфон) C6H5SO2C6H5, мол. м. 218,27; сероватые кристаллы: т. пл. 128-130°С, т. кип. 379°С, 232°С/18мм рт. ст.; d420 1,355, d4141,5 1,157; m 16,76.10-30 Кл.м (бензол); окислит.-восстановит. потенциал в 80%-ном водном спирте E1/2 - 2,12 В; g 37,77 мН/м (137,5 °С); р-римость в 100 г эфира: l,2 г (0°С), 2,56 г (25 °С); раств. в горячем спирте, жидком NH3, уксусной к-те, умеренно - в бензоле, практически не раств. в холодной воде, плохо - в горячей. Дифенилсульфон восстанавливается при кипячении в 75%-ном водном спирте (кат. - Ni) до бензола; гидролизуется при кипячении в разб. водном р-ре КОН до бензолсулъфокислоты и бензола, а при плавлении с КОН при 220°С - до фенола и бензола. При нагр. с дымящей H2SO4 при 100-120°С превращается в 3-(фенилсульфонил)бензолсульфокислоту (ф-ла I), при 230 °С - в бензол-1,3-дисулъфокислоту, при взаимод. с бутиллитием в эфире с послед. насыщением р-ра СО2 - в 2-(фенилсульфонил)бензойную к-ту (II) и бис-(2-карбоксифенил)сульфон (III).
Нитруется конц. HNO3 при 20 °С с образованием 2,4,6-тринитрорезорцина (стифниновой к-ты; IV) и отщеплением бензолсульфокислоты.
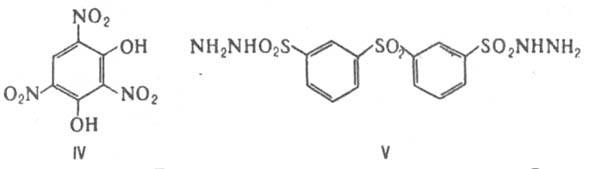
В пром-сти дифенилсульфон получают пропусканием паров бензола через колонку с 95%-ной H2SO4, нагретую до 260 °С, или взаимод. бензолсульфохлорида с бензолом при 80-110 °С (кат.- FеСl3). Препаративные способы: взаимод. бензола с бензолсульфохлоридом при 30 °С (кат.- АlСl3); окисление дифенилсульфида избытком Н2О2 в уксусной к-те при 20 °С. Применяют дифенилсульфон и нек-рые его производные, напр. 4-хлордифенилсульфон (т. пл. 94-98 °С), 2,4,4',5'-тетрахлордифенилсульфон (т. пл. 145-147 °С), как акарициды; дигидразид дифенилсульфон-3,3'-дисульфокислоты (ф-ла V) - как порообразователь. Литература
