Нейраминидаза
НЕЙРАМИНИДАЗА (сиалидаза, ацилнейраминазил-гидро-лаза), фермент класса гидролаз, катализирующий гидролиз a-кетозидной связи между остатком N-ацетилнейраминовой к-ты и соседним моносахаридом в олигосахаридах, глико-протеинах или гликолипидах, напр.:
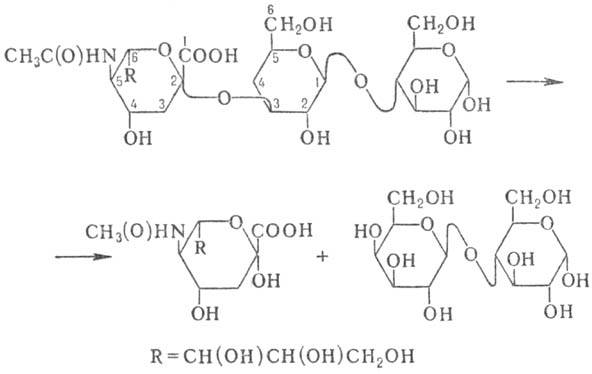
Нейраминидаза широко распространена в природе, она входит в состав оболочек нек-рых вирусов; обнаружена в ряде патогенных микроорганизмов (впервые нейраминидаза была открыта в культуре возбудителей газовой гангрены Clostridium perfringens), a также у позвоночных и беспозвоночных животных. У растений нейраминидаза не обнаружена.
Фермент строго специфичен по отношению к конфигурации кетозидной связи и относительно специфичен к положению этой связи в молекуле. Нейраминидаза из холерного вибриона и возбудителя газовой гангрены, обычно применяющиеся в лаб. практике, могут расщеплять a-2 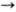 3- и a-2
3- и a-2 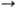 6-кето-зидные связи. Вирусные нейраминидазы, как правило, обладают более строгой специфичностью по отношению к положению а-кетозидной связи. Фермент не требует кофакторов, но нек-рые из нейраминидаз активируются ионами Са2+ .
6-кето-зидные связи. Вирусные нейраминидазы, как правило, обладают более строгой специфичностью по отношению к положению а-кетозидной связи. Фермент не требует кофакторов, но нек-рые из нейраминидаз активируются ионами Са2+ .
Нейраминидазы из мн. источников выделены и очищены до индивидуального состояния. Нейраминидаза из вирусов гриппа состоит из четырех идентичных субъединиц с мол. м. ок. 33,5 тыс. Для этого фермента идентифицированы антигенные детерминанты и их расположение в молекуле. Оптимальная каталитич. активность фермента в зависимости от источника проявляется при разных значениях рН (обычно при рН 3,5-7).
Нейраминидаза играет важную роль в организме животных, ее отсутствие приводит к тяжелым заболеваниям-сиалидозам. Фермент широко применяют в лаб. практике, для установления структуры углеводных цепей.
Лит.: Химия углеводов, М., 1967, с. 602-21; Видершайн Г. И., Биохимические основы гликозидозов, М., 1980; Gottschalk A., Drzeniek К., в кн.: Glycoproteins. Their composition, structure and function, 2 ed., pt A, Amst.- L- N. Y., 1972, p. 381 -402; Cell biology monographs; sialic acids, ed. by R. Schauer, v. 10, N. Y., 1982. Н. Д. Габриэлян.
