Моноаминоксидазы
МОНОАМИНОКСИДАЗЫ [амин: кислород - оксидоредук-тазы(дезаминирующие)(содержащие флавин), МАО], ферменты класса оксидоредуктаз, катализирующие окислит. дезаминирование алифатич. жирно-ароматич. и гетероцик-лич. моноаминов по схеме:
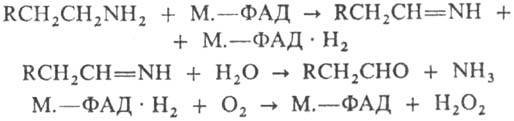
М-моноаминооксидаза, ФАД (флавинадениндинуклео-тид) - кофермент (см. Рибофлавин).
Моноаминоксидаза-гликопротеин, в углеводную часть к-рого входят остатки сиаловой к-ты и гексозаминов. Молекула фермента состоит из двух субъединиц (мол. масса каждой ок. 60 тыс.), на одной из к-рых находится активный центр, содержащий ФАД. В состав активного центра входят также остатки гистидина и по крайней мере 2 из 7-8 принадлежащих ферменту групп SH, к-рые необходимы для проявления каталитич. активности. Величина рН, при к-рой проявляется максю каталитич. активность, зависит от источника фермента и находится в области 7,5-9,0; рI 4,7-5,3. Известны первичные структуры нек-рых моноаминоксидаз и созданы гипотетич. модели строения их активного центра.
Два осн. изофермента моноаминоксидаз (А и Б) различаются по аминокислотному составу, мол. массе субъединиц (примерно на 3 тыс.), чувствительности к ингибиторам и по субстратной специфичности. Наиб. специфич. ингибитор моноаминоксидазы A-N-3-(2,4-дихлорфенокси)пропил-N-метил-2-пропиниламин (хлоргилин); моноаминоксидаза Б избирательно ингибируется М-(1-метил-2-фенилэтил)-N-метил-2-пропиниламином (депренилом). Эти ингибиторы необратимо алкилируют ФАД. Специфичность обоих ингибиторов проявляется только в низких концентрациях. Существуют также ингибиторы др. строения и механизма действия, напр. производные гидразина (см. Антидепрессанты). Специфич. субстраты моноаминоксидазы А-серотонин и норадрена-лин, моноаминоксидазы Б-2-фенилэтиламин и бензиламин. Обе формы моноаминоксидаз одинаково хорошо окисляют тирамин [2-(4-гидроксифенил)-этиламин].
Моноаминоксидаза содержится гл. обр. в печени, почках, мозге, тромбоцитах и плаценте млекопитающих, в печени и мозге рыб, а также в нек-рых бактериях, напр. в кокках Sarcina luteae. Обычно фермент расположен в мембранах митохондрий в комплексе с фосфолипидами, в нек-рых клетках моноаминоксидаза находится в мембранах эндоплазматич. ретикулума и в цитоплазме. Считается, что моноаминоксидаза защищает организмы от воздействий биогенных аминов путем их инактивации и регулирует содержание серотонина и норадреналина в нервной ткани. Мн. продукты р-ций, катализируемых моноаминоксидазой, также обладают биол. активностью и способны оказывать специфич. воздействие на обмен в-в.
Активность моноаминоксидаз чаще всего определяют с помощью аминов, меченных 14С, анализируя образование меченых альдегидов, избирательно экстрагируемых нек-рыми орг. р-рите-лями; применяют также методы, основанные на определении NH3 и Н2О2.
В пром-сти иммобилизованные моноаминоксидазы используют в тир-амин-чувствит. электродах, предназначенных для контроля свежести мяса.
Исп. литература для статьи «МОНОАМИНОКСИДАЗЫ»: Горкин В.З., Аминоксидазы и их значение в медицине, М., 1981; Monoamine oxtidase. Basic and clinical frontiers, ed. by K. Kamijo, E. Usdin, T. Nagatsu, Amst.-Oxf.-Princeton, 1982; Structure and functions of amine oxidases, ed. by B. Mondovi, Florida, 1985. B.A. Пеккель.
