Пищимуки реакция
ПИЩИМУКИ РЕАКЦИЯ, превращение тионфосфорных соед., содержащих хотя бы одну алкоксигруппу у атома P в соответствующие тиоловые эфиры при действии алкил-галогенидов (т. наз. тион-тиольная перегруппировка):
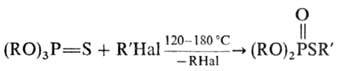 I
I
Аналогичные превращ. происходят при действии на тион-фосфорные соед. к-т Льюиса, солей аммония или фосфония, а также при термич. изомеризации исходного соед.; при этом одна молекула тионфосфата выступает в качестве алкилирующего агента:

У аллиловых эфиров тионфосфорных к-т изомеризация сопровождается аллильной перегруппировкой:
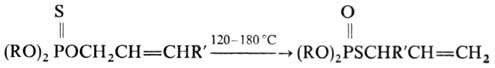
Термич. изомеризация несимметричных триалкилтионфос-фатов приводит к смеси изомеров. В случае диалкиларил-и алкилдиарилтионфосфатов в изомеризации участвует алкоксильная группа, напр.:
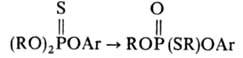
Перегруппировка облегчается наличием электронодонор-ных заместителей у атома P. Так, легкость протекания Пищимуки реакции снижается в ряду: R2P(S)OR' > RP(S)(OR')2 > (RO)3PS.
Один из возможных механизмов перегруппировки включает образование квазифосфониевого соед. с послед, элиминированием алкилгалогенида:
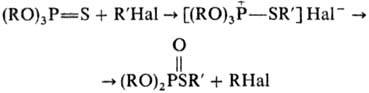
Побочные продукты р-ции - метафосфаты, диалкилсуль-фиды и соли сульфония.
Тионфосфаты, содержащие в b-положении алкильного радикала гетероатом с неподеленной парой электронов, изомеризуются в более мягких условиях, чем алкиловые эфиры. Так, диэтил (2-этилтиоэтил)тионфосфат при 90 0C за 24 ч изомеризуется на 50% (р-ция ускоряется в полярном р-рителе). В этом случае в качестве промежут. продукта, по-видимому, образуется сульфониевый ион:
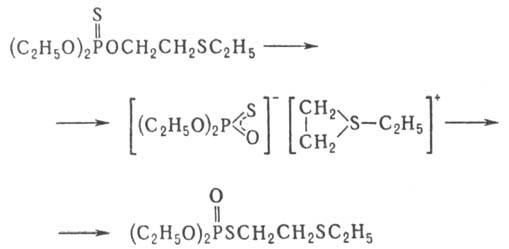
Пищимуки реакцию используют в пром-сти при получении инсектицидов (напр., меркаптофоса), а также в лаб. синтезе, напр. при получении этилтиодихлорфосфата:
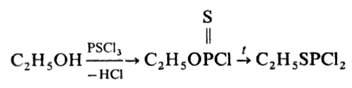 Р-ция открыта П. С. Пищимукой в 1908.
Р-ция открыта П. С. Пищимукой в 1908.
Лит.: Нифантьев Э. E., Химия фосфорорганических соединений, M., 1971, с. 172; Арбузов Б. А., в кн.: Химия и применение фосфорорганических соединений, M., 1972, с. 19-21; Тейхман X., там же, с. 249-54.
В. А. Гиляров.
