6.2. Влияние температуры на растворимость поверхностно-активных веществ
Прежде чем перейти непосредственно к обсуждению мицеллообразования, необходимо хотя бы кратко рассмотреть влияние температуры на растворимость различных ПАВ.
Современные тенденции использования тканей из смесей волокон и необходимость создания энергосберегающей технологии облагораживания тканей и стирки изделий заставляют разрабатывать такие композиции моющих средств, которые были бы эффективными при низких температурах моющей ванны. Это приводит к тому, что в качестве активных компонентов ТВВ и СМС могут быть использованы лишь те ПАВ, которые хорошо растворяются при сравнительно низких температурах.
В процессах облагораживания тканей из хлопка в технологических процессах на текстильных предприятиях обычно проводят нагревание пропитанных технологическими растворами тканей до температуры »100o C. Существует ряд неионогенных ПАВ, которые при этой температуре выделяются из раствора, так как этот класс ПАВ обладает способностью к снижению растворимости при нагревании в результате дегидратации оксиэтиленовых цепочек. Поэтому нас будет интересовать влияние температуры на растворимость ПАВ как в холодной, так и в горячей воде.
Многие ПАВ, как ионные, так и неионогеиные, имеют кривые растворимости с верхней критической температурой смешения. Растворимость неионогенных ПАВ, кроме того, ограничена также кривой с нижней критической температурой смешения. Область температур, в которой ПАВ растворяются в концентрациях, достаточных для использования их в составе моющих композиций, зависит от длины углеводородного радикала, природы полярных групп анионактивных веществ и степени оксиэтилирования неионогенных. Растворимость ионогенных веществ обычно характеризуют точкой Крафта (Ткрит), т.е. такой температурой, выше которой ПАВ начинает растворяться практически неограниченно. Такая же характеристика может быть использована и для неионогенных ПАВ с невысокой степенью оксиэтиэтилирования. Повышение температуры растворов, приводящее к дегидратации молекул неионогенных ПАВ, вызывает выделение растворенных молекул в виде отдельной макрофазы. Температуру, выше которой неионогенные ПАВ выделяются из растворов, можно характеризовать точкой (температурой) помутнения Тп. Обычно температуру помутнения с достаточной точностью можно определить визуально по резкому возрастанию мутности растворов при постепенном нагревании. Следует помнить, что процесс разделения фаз в растворах ПАВ носит релаксационный характер и экспериментальные значения Тп зависят от скорости нагревания.
Еще в конце прошлого столетия (1896 г.) Крафт при изучении растворения мыл в воде установил необычную температурную зависимость их растворимости.
Последующие многочисленные исследования показали, что такая зависимость характерна для многих коллоидных поверхностно-активных веществ. В частности, Мэррей и Гартли показали, что растворимость длинноцепочечных коллоидных анионактивных ПАВ, например цетилсульфоната натрия, также изменяется с повышением температуры необычным образом. Незначительная при низких температурах растворимость их с повышением температуры увеличивается незначительно и монотонно, а затем в довольно узком критическом интервале температур возрастает очень резко, скачкообразно. Аналогичные исследования были проведены на ряде других катион- и анионактивных коллоидных ПАВ.
Интенсивное увеличение растворимости, сказывающееся в резком перегибе кривых, имеет место в том интервале температур и концентраций, где начинается образование мицелл, т. е. соответствует критической области мицеллообразования. Это указывает на относительно малую растворимость ионов в сравнении с «растворимостью» мицелл. Следует, однако, отметить, что, так как мицелла является частицей коллоидных размеров, подобное сопоставление «растворимости» с растворимостью отдельных ионов или молекул не имеет строгого характера. Однако если не вдаваться в существо процесса, резкое увеличение растворимости твердой фазы указывает на то, что переход последней в раствор происходит независимо от степени агрегирования.
Растворимость типичных ионогенных ПАВ, состоящих из углеводородного радикала и гидрофильной ионной группы, зависит от числа углеродных атомов в гидрофобной части молекулы. Некоторое влияние оказывает природа ионной группы, а также сопутствующий катион - противоион. Обычно эти вещества плохо растворимы в холодной воде и выделяются из раствора при охлаждении до определенной температуры.
|
Для многих ионных ПАВ, имеющих практическое значение, такая температура находится в пределах 30-50°С. Снизить ее можно либо смешивая анионактивные вещества с неионогенными, либо вводя оксиэтиленовые группы в молекулы анионактивных веществ.
Сульфатирование ПАВ позволяет получить перспективный класс веществ. Введение оксиэтиленовых групп приводит к улучшению растворимости при низких температурах, снижению точки Крафта, а наличие ионной гидрофильной группы придает этому классу ПАВ хорошую растворимость при повышенных температурах.
После определения координат точки Крафта, температурной зависимости растворимости и температурной зависимости ККМ строят диаграмму состояния системы «ПАВ-вода». Пример такой диаграммы приведен на рис. 2.54. Стрелками показаны координаты точки Крафта. Области на диаграмме: I- мицеллы«молекулы, II- молекулы, III- кристаллы. Линии равновесия: 1 – кристаллы«мицеллы, 2 – кристаллы«молекулы, 3 – молекулы«мицеллы.
Неионогенные ПАВ растворяются в воде в результате гидратации эфирных атомов кислорода оксиэтиленовых групп. Их растворимость определяется балансом энергий взаимодействия:
DE=Е12-Е11- Е22,> 0, (2.6.5)
где Е11– энергия взаимодействиямолекулводы;Е12- энергия взаимодействиямолекулводыс эфирными атомами кислорода оксиэтиленовой цепочки ПАВ; Е22- энергия взаимодействиямолекулПАВ в кристаллах.
При повышении температуры все три вида энергии уменьшаются, но интенсивность их изменения такова, что при низких температурах будет преобладать энергия взаимодействия Е22, в результате чего неионогенное ПАВ будет растворяться ограниченно и в равновесии с кристаллами ПАВ будет разбавленный молекулярный раствор. Присутствие полиэтиленгликолей, образующихся как примесь при синтезе неионогенных веществ методом оксиэтилирования, в образцах ПАВ исключает образование кристаллов.
Таким образом, снижение растворимости неионогенных ПАВ при понижении температуры раствора ниже некоторой критической приводит к выделению растворенного вещества. При этом система разделяется на две несмешивающиеся фазы, одна из которых представляет водный раствор неионогенного ПАВ, а другая - кристаллогидрат этого вещества. Установлено, что кристаллы неионогенных ПАВ имеют типичную для кристаллов мыл игольчатую форму.
Если повышать температуру раствора, то кристаллогидраты начинают растворяться, и система из гетерогенной переходит в гомогенную. Эта температура, подобно температурной границе точки Крафта будет характеризовать фазовое превращение - растворение кристаллов ПАВ.
Дальнейшее нагревание раствора приводит к тому, что система вновь разделяется на две несмешивающиеся фазы - раствор неионогенного ПАВ и выделившееся дегидрагированное вещество. Начало этого фазового разделения характеризуется резким возрастанием мутности раствора. При последующем увеличении температуры мутность увеличивается и после достижения некоторого максимального значения происходит уменьшение мутности вследствие выделения капелек неионогенного ПАВ и образования макрофазы. Температура этого фазового разделения может определяться визуально.
Таким образом, растворимость неионогенных веществ в воде имеет две ярко выраженные температурные границы: нижнюю границу растворения, связанную с недостаточной кинетической энергией молекул ПАВ, и верхнюю границу растворения, связанную с уменьшением гидратации эфирного кислорода оксиэтиленовых групп.
Рис. 2.55. Фазовая диаграмма водного раствора неионогенного ПАВ (на примере ДС-7) |
Увеличение концентрации растворенного вещества смещает нижнюю температурную границу растворения в сторону более высоких значений температуры. При этом фазовый переход проявляется более четко в растворах с высокой концентрацией.
Температура помутнения имеет экстремальную зависимость от концентрации растворенного вещества. Такое влияние концентрации растворенного неионогенного ПАВ должно быть связано с изменением в мицеллярной структуре раствора при изменении концентрации.
На рис. 2.55. показана типичная диаграмма состояния раствора неионогенного ПАВ (на примере ДС-7). На этом рисунке: 1-зависимость температуры помутнения растворов от концентрации, 2- зависимость температуры растворения от концентрации, 3- зависимость ККМ от температуры; I- кристаллы« молекулы, II- мицеллы« молекулы, III- эмульсия ПАВ« молекулы, IV- молекулярный раствор.
Очень часто в технологической практике и в быту используются технические неионогенные ПАВ, в образцах которых присутствуют примеси полиэтиленгликолей, препятствующие образованию кристаллов. Они растворяются при низких температурах, но выделяются при нагревании. Поэтому на диаграммах состояния у них присутствует только кривая равновесия с нижней критической температурой смешения.

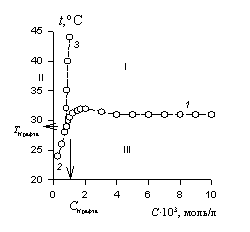 Рис. 2.54.
Рис. 2.54. 

