Квасцы
КВАСЦЫ, кристаллогидраты двойных сульфатов состава МIМIII(SО4)2.12Н2О [или M2SO4.M2III(SO4)3.24H2O], где М1 - однозарядный катион -Na+, K+, Rb+, Cs+, NH+4, Тl+, CH3NH3+ и др., МIII - трехзарядный катион - А13+, Сг3+, Fe3+, Ga3+, In3 и др. Существуют также селенатные квасцы аналогичного состава MIMlII(SeO4)2.12Н2О. Двухзарядные катионы образуют т. наз. псевдоквасцы сходного с квасцами состава, но иной структуры, напр. FeSO4 .A12(SO4)3324Н2О. Известно неск. десятков разл. квасцов. Способность к образованию квасцов, их устойчивость возрастают по мере увеличения радиуса М+ и уменьшения радиуса М3+ (при сходной внеш. электронной оболочке). При этом более сильное влияние на св-ва квасцов оказывает природа М+ . Так, алюмолитиевые квасцы, в отличие от алюминиевых квасцов с более крупными катионами (Na+, К+ и др.), при т-ре 20-25°С не образуются, а м.б. получены лишь при т-ре ок. -2°С. Катион А13+ (ионный радиус 0,057 нм) дает квасцы с Li+, Na+ , К+ , NH+4, Rb+, Cs+, в то время как In3+ (0,092 нм) - только с Cs+, Rb+ и NH4 в виде метастабильных фаз. У квасцов, содержащих один и тот же катион М3+ , в ряду Na, К, NH4, Rb, Cs р-римость в воде падает, а т-ра плавления и их термич. устойчивость увеличиваются (см. табл.). Квасцы легко выделяются из водных р-ров в виде больших октаэдрич. кристаллов с кубич. решеткой (z = 4, пространств, группа РаЗ). Известны три структурные разновидности квасцов - a, b и g, отличающиеся друг от друга ориентацией тетраэдров SO4 по отношению к М+ и нек-рыми др. признаками. Эти различия обусловлены размером однозарядного катиона. b-Квасцы содержат относительно большие катионы (Cs+, CH3NH3+), a-катионы меньшего размера (К+, Rb+), единств, представитель g-квасцов NaAl(SO4)2.12H2O. В кристаллич. структурах всех квасцов катионы М3+ и М+ координируют по 6 молекул воды. В Р-квасцах в координац. сферу М+ входят также 6 атомов кислорода анионов SO2-4. a- И b-квасцы образуют твердые р-ры между собой, g-квасцы твердых р-ров с др. квасцами не дают. Квасцы обладают вяжущим и кислым вкусом, их водные р-ры имеют кислую р-цию вследствие гидролиза. При нагр. квасцы плавятся в кристаллизац. воде, затем дегидратируются в две или неск. стадий с образованием промежут. кристаллогидратов, напр. NaAl(SO4)2.6H2O, KAl(SO4)2.8Н2О, KAl(SO4)2.2H2O. Конечные продукты дегидратации - безводные, или "жженые", квасцы.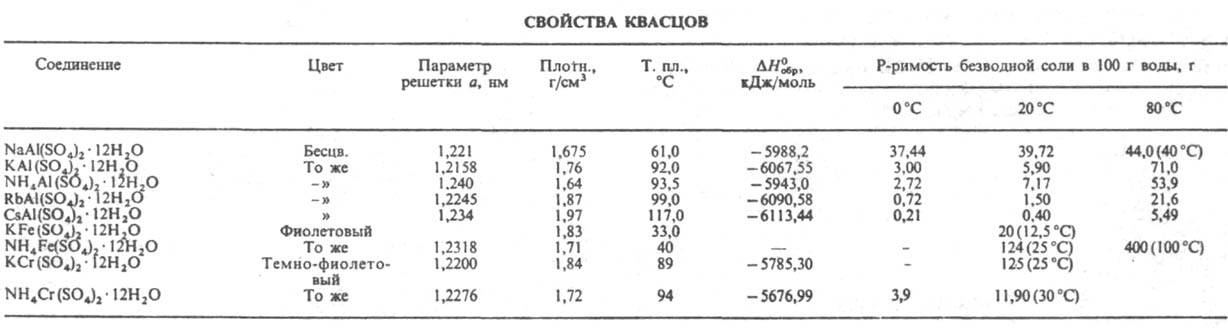
В природе встречаются алюмокалиевые квасцы, алюмонатpиевые (минерал сольфатерит) и алюмоаммониевые (минерал чермигит). Алюмокалиевые квасцы получают обжигом алунита K2SO4.A12(SO4)3.Аl(ОН)3 с послед. выщелачиванием сульфатов К и Аl водой и кристаллизацией квасцов из р-ра, а также разложением нефелина серной к-той при нагревании с послед. взаимод. полученного р-ра с квасцами Сl. Алюмонатриевые квасцы производят при переработке нефелина или упариванием р-ров сульфатов Na и Аl. Железо-аммониевые квасцы получают кристаллизацией из р-ра, содержащего сульфаты Fe(III) и аммония, хромово-калиевые квасцы - восстановлением К2Сr2О7 в разб. H2SO4 щавелевой к-той, спиртом и др. Практич. применение находят в осн. алюминиевые, хромово-калиевые и железо-аммониевые квасцы- как дубильные в-ва в кожевенной пром-сти (хромовые и алюминиевые квасцы), протравы при крашении тканей (хромовые, алюминиевые и железные квасцы), для проклеивания бумаги в бумажной пром-сти, в качестве кровоостанавливающего и прижигающего ср-ва в медицине (алюминиевые квасцы), коагулянтов при водоочистке и очистке сточных вод (алюминиевые и железные квасцы), реактива в фотографии (железные и хромовые квасцы), реагента в аналит. химии для обнаружения ионов NCS-, PO3-4, AsO3-4 и др. (железные квасцы). Лит.. Позив М. Е., Технология минеральных солей, 4 изд., ч. 1, Л.. 1974, с. 566, 613. 632, 635, 640. 653; Крисанова Л. П., "Ж. неорг. химии". 1986. т. 31, в 6, с. 1551 55 В. П. Данилов.
Синонимы/примеры:*
Алюминиево-калиевые квасцы; Калийные квасцы; Алюмокалиевые квасцы; Квасцы алюмокалиевые
*подобраны ИИ, возможны неточности
Ещё по теме
Квасцы
Железные квасцы в аналитической химии
Алюминиевые квасцы — что это и где применяются
Хромовые квасцы — свойства и применение
Жжёные квасцы — что это и для чего применяются?
Квасцы — свойства и применение в медицине
Калия-кальция сульфат моногидрат — свойства и применение
Калия сульфат — свойства и применение
Калий — свойства и применение
Калия хлорид — свойства и применение
Калия оксалат моногидрат — свойства и характеристики
Растворимые соли алюминия
Кварц — свойства и применение
