Тиофенолы
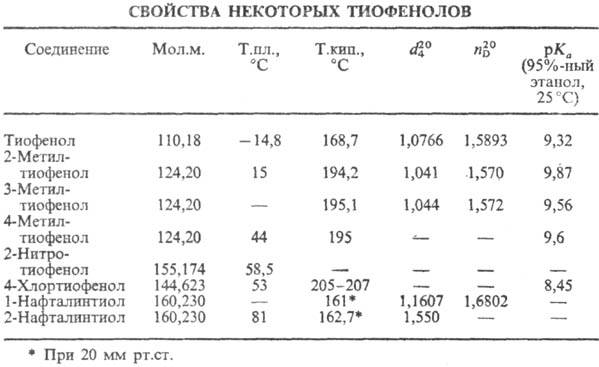
ТИОФЕНОЛЫ (арентиолы, ароматич. тиолы) ArSH, где Ar-фенил, нафтил (в т.ч. замещенные) и др. Жидкие или кристаллич. в-ва; плохо раств. в воде, раств. в орг. р-рите-лях. Тиофенолы-более сильные к-ты, чем фенолы (см. табл.).
В ИК спектрах тиофенолов характеристич. полосы поглощения группы SH лежат в области 2500-3000 см-1. В УФ спектрах присутствуют 2 полосы, напр. для C6H5SH lмакс240 и 270 нм, e ~ 105 и ~700 соотв. (p : p*-переходы). В спектре ПМР хим. сдвиг (d) протона группы SH-в области 3-4 м.д. (СCl4).
В разб. р-рах тиофенолы находятся в мономерной форме, в конц. р-рах ассоциируются благодаря межмол. или внутримол. водородным связям.
Тиофенолы обладают всеми хим. св-вами, характерными для тиолов.
Получают тиофенолы обычно косвенными методами с использованием металлоорг. соединений., напр.:
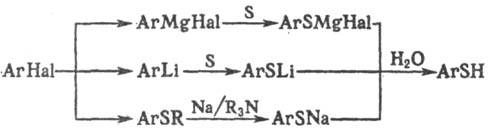
Тиофенолы образуются из первичных ароматич. аминов через соответствующие диазониевые соли, напр.:
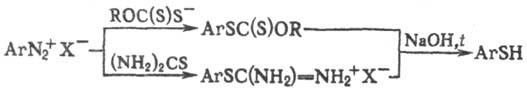
Используют также р-ции диазониевых солей с Na2Sx (x 2) с образованием ArSxAr либо с (CuSCN)2 с образованием ArSCN с послед, восстановлением Zn в СН3СООН, NaBH4 или LiAlH4.
2) с образованием ArSxAr либо с (CuSCN)2 с образованием ArSCN с послед, восстановлением Zn в СН3СООН, NaBH4 или LiAlH4.
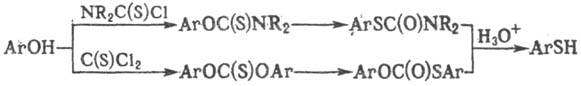
Тиофенолы могут быть получены из фенолов; последние переводят в О-арилтиокарбаматы либо эфиры тиолкарбоновых к-т и далее подвергают термич. перегруппировке (см. Ньюмена-Кворта реакция) и гидролизу, напр.:
Разработан способ получения тиофенолов р-цией хлораренов с H2S или алкантиолами в газовой фазе:
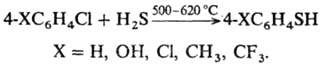
Для получения тиофенолов используют также р-цию ароматич. углеводородов с серосодержащими электрофилами (только для соед. с электронодонорными заместителями; ур-ние 1); восстановление дисульфидов (2, восстановители-LiAlH4, NaBH4, глюкоза, Zn в СН3СООН, РРh3 в СН3ОН); взаимод. галогенаренов с CH3SNa в гексаметаполе (3):
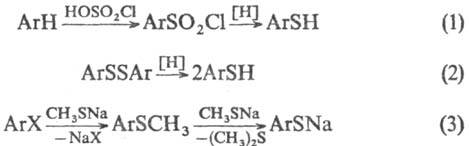
X = Сl, Вr; Аr = Ph, нафтил и др.
Применяют тиофенолы в синтезе лек. препаратов, пестицидов, полимеров и др.
Лит. см. при ст. Тиолы. Э. Н. Дерягина.
