Фотоэлектрохимия
ФОТОЭЛЕКТРОХИМИЯ, изучает процессы взаимного преобразования световой и электрич. энергии в системе электрод - электролит. Наиб. распространены процессы преобразования энергии света в хим. и электрич. энергию, сопровождающиеся протеканием фототока в цепи освещаемой элект-рохим. ячейки, т.е. фотоэлектрохим. р-ции. Обратный процесс - испускание света при прохождении электрич. тока через ячейку - может иметь природу электрохемилюминес-ценции, газового разряда в зазоре между электродом и электролитом и т. д. В широком смысле фотоэлектрохимия включает описание любых изменений на границе раздела электрод - электролит при освещении, в т. ч. и в отсутствие тока, напр. возникновения фотопотенциала и фотоемкости идеально поляризуемого электрода (см. Двойной электрический слой).
Протекание фототока в электрохим. цепи м. б. вызвано фотовозбуждением электрода или р-ра электролита. При поглощении квантов света образуются первичные возбужденные состояния электронов, ионов или молекул, обычно ко-роткоживущие; далее они вступают в необратимые хим. и электрохим. взаимод., заканчивающиеся образованием стабильных продуктов фотоэлектрохим. р-ции. Частицы стабильных продуктов запасают в себе, по крайней мере, часть первоначально поглощенной энергии света, другая часть расходуется (инактивируется) в ходе обратных р-ций, рекомбинации и т. п., причем поглощенная энергия света превращается в тепло.
В случае металлич. электрода фотовозбуждение обусловлено переходом поглотивших квант света валентных электронов на более высокие энергетич. уровни. Возбужденные электроны с энергией, превышающей работу выхода из металла, и имеющие отличный от нуля импульс в направлении нормали к пов-сти электрода могут покинуть металл и перейти в делокализованном состоянии в р-р, образуя ток фотоэлектронной эмиссии (фототок). Фототок I зависит от энергии кванта света hn(h - постоянная Планка, n - частота) и потенциала электрода E по т. наз. закону пяти вторых:
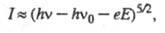
где hn0 - работа выхода электрона из металла в р-р при E = 0 (n0-пороговая частота фотоэмиссии), е- заряд электрона. Квантовый выход фототока, равный отношению числа электронов, перенесенных в электрохим. цепи, к числу падающих на электрод фотонов, невелик, порядка 10-4; при обычно применяемой освещенности электрода фототок составляет порядка 10-5 А/см2.
Попавшие в р-р электроны сольватируются р-рителем; сольватир. электроны вступают в хим. реакции с компонентами р-ра, восстанавливая их (напр., ион H+ - до атомарного водорода). Продукты восстановления могут восстанавливаться далее либо окисляться обратно на пов-сти электрода в ходе "темновых" (в отсутствие освещения) электрохим. р-ций. Так, атомарный водород при положит. электродных потенциалах окисляется до H+, а при отрицательных превращается в H2. Измерение фототока лежит в основе методов исследования сольватир. электронов и продуктов их хим. р-ций.
При фотовозбуждении полупроводника электроны валентной зоны, поглотив квант света, переходят в зону проводимости, оставляя в валентной зоне положительно заряженные дырки. Электроны проводимости и дырки могут вступать в электрохим. р-ции, соотв. катодные и анодные, обусловливающие фототек. Скорость р-ций и, следовательно, фототок увеличиваются с концентрацией фотогенерир. электронов и дырок (см. Электрохимия полупроводников).
При поглощении квантов света ионами и молекулами р-ра электролита последние переходят в возбужденное состояние. Электродные потенциалы окислит.-восстановит. систем, в состав к-рых входят возбужденные ионы или молекулы, не совпадают с потенциалами тех же систем в невозбужденном состоянии. Поэтому при освещении могут протекать элект-рохим. р-ции с участием возбужденных частиц, к-рые в невозбужденном состоянии тех же частиц (как темновые процессы) не идут. Поскольку время жизни возбужденных состояний невелико (обычно не более 1 мс), в электрохим. р-циях участвуют только частицы, образованные в непосредственной близости к пов-сти электрода или адсорбированные на этой пов-сти. Так, адсорбированные на пов-сти полупроводникового электрода красители родамин Б, бенгальский розовый и др., поглощающие видимый свет и в возбужденном состоянии окисляющиеся (т. е. отдающие электрон полупроводнику), используются в качестве сенсибилизаторов, повышающих чувствительность широкозонных полупроводников (TiO2, ZnO) к видимому свету.
Фотолиз р-ра при его освещении приводит к образованию стабильных продуктов, в числе к-рых м. б. окислители и восстановители, способные вступить в злектрохим. р-ции на электродах. В ячейке с селективными электродами, один из к-рых избирательно чувствителен по отношению к окислителю, а другой - к восстановителю, освещение р-ра генерирует ток во внеш. цепи, при этом происходит преобразование световой энергии в электрическую.
Фотоэлектрохим. ячейку характеризуют: кпд, равным отношению произведенной электрич. и(или) хим. энергии к энергии падающего (иногда - поглощенного) света, фотоэдс разомкнутой цепи и фототок короткого замыкания. Эти величины тем выше, чем большая доля первичных возбужденных состояний, образовавшихся при поглощении квантов света, избегает инактивации и вступает в полезные электрохим. р-ции. Напр., фотогальванич. ячейка, чувствительная к свету с длиной волны 450-650 нм, основана на фотовозбуждении р-ра, содержащего тиазиновый краситель тионин и Fe2+. Возбужденный светом тионин окисляет Fe2+ до Fe3+, сам при этом восстанавливаясь. Далее Fe3+ восстанавливается на одном из электродов ячейки, а восстановленная форма тио-нина окисляется на другом, при этом в р-ре регенерируются исходные в-ва. Такая электрохим. ячейка имеет кпд ок. 0,1%.
Фотоэлектрохим. р-ции используют для травления полупроводниковых материалов. Поскольку скорость анодного травления увеличивается с ростом интенсивности освещения, неравномерное освещение полупроводникового анода позволяет вытравливать на его пов-сти заданный-рельеф. Напр., травлением GdS, GaAs и др. в интерферирующих лазерных пучках получают дифракционную решетку с разрешением до 6000 линий/мм.
Достижения фотоэлектрохимии позволяют реализовать прямое преобразование солнечной энергии в хим. энергию продуктов фотоэлек-трохим. р-ций и энергию электрич. тока. Фотоэлектрохим. элементы для преобразования солнечной энергии делятся на элементы для фотоэлектролиза и элементы для произ-ва электрич. энергии (т. наз. жидкостные солнечные батареи). Так, для фотоэлектролиза воды служит ячейка с кислым электролитом и фотокатодом из InP (полупроводник p-типа), на пов-сть к-рого нанесен микроосадок Pt или Rh для повышения электрокаталитич. активности. При освещении на InP выделяется H2; кпд преобразования солнечной энергии в химическую составляет 6-8%. Примеры "жидкостных солнечных батарей": элемент с фотоанодом из GaAs n-типа и щелочным р-ром K2Se + K2Se2, элемент с фотоанодом из CuInSe2 и р-ром KI+ KI3 + HI; их кпд достигает 12-15%. Наиб. эффективные полупроводниковые фотоэлектроды изготавливают из кремния, фосфида индия, арсенида галлия, теллурида и селенида кадмия.
Лит.: Гуревич ЮЛ. [и др.], в кн.: Итога науки н техники, сер. Радиационная химия. Фотохимия, т. 1,М., 1978; Гуревич ЮЛ., Плесков Ю.В., Фотоаиектрохимия полупроводников, M., 1983; Плесков Ю.В., Фотоэлект-рохимическое преобразование солнечной энергии, M., 1990. Ю.В. Плесков.
