Мeйера реакция
МEЙЕРА РЕАКЦИЯ, получение алифатич. нитросоедине-ний действием AgNO2 на первичные алкилгалогениды (обычно бромиды и иодиды, реже - хлориды):
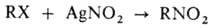
Осуществляют Мейера реакцию чаще всего в абс. эфире, иногда в петролейном эфире или ацетонитриле при 0-20 °С. Высокий выход нитроалканов (до 80%) дают первичные неразветвленные или разветвленные в b-положении алкилгалогениды, напр. гексилбромид, изобутилхлорид и др. Разветвленные в a-положении галогениды (напр., изопропилбромид) образуют нитроалканы с низкими выходами или вовсе не дают желаемых продуктов (напр., неопентилбромид). Р-ция со вторичными и третичными алкилгалогенидами также идет с низкими выходами, к-рые обычно не превышают соотв. 25 и 4-6%. С алкилгалогенидами, содержащими различные функциональные группы, р-ция протекает с хорошим выходом. Так, эфиры a-галогенокислот в Мейера реакции образуют соответствующие эфиры a-нитрокислот с выходом 75-84%, напр.:
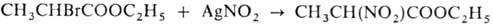
Первичные дигалогениды превращ. в динитроалканы:
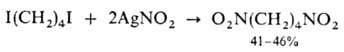
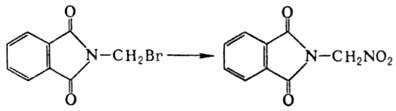
В Мейера реакцию вступают также алициклич., жирно-ароматич. и нек-рые гетероциклич. галогениды, напр.:
Побочные продукты-нитриты и нитраты.
Модификация Мейера реакции-действие на алкилгалогениды р-ров NaNO2(KNO2) в ДМСО или ДМФА (модификация Корн-блюма). Такой метод позволяет с выходом 55-65% получать вторичные нитросоединения разл. типов. Др. модификация-проведение р-ции в условиях межфазного катализа. Так, взаимод. алкил- или бензилгалогенидов с NaNO2 в ацетонитриле в присут. 18-краун-6-эфира приводит к получению нитроалканов с выходом 65-70%.
Мейера реакция используется в осн. для получения первичных нитроалканов. Р-ция открыта В. Мейером в 1872.
Исп. литература для статьи «МEЙЕРА РЕАКЦИЯ»: Корнблюм Н., в кн.: Органические реакции, сб. 12, М., 1965, с. 117-55; Вацуро К. В., Мищенко Г. Л., Именные реакции в органической химии, М., 1976; Houben- Weyl, Methoden der organischen Chemie, 4 Aufl., Bd 10, Tl 1, Stuttg., 1971, S. 46. Л. А. Яновская.
