Риттера реакция
РИТТЕРА РЕАКЦИЯ (Риттера - Графа р-ция), получение N-замещенных амидов карбоновых к-т взаимод. нитрилов с олефинами или их производными (напр., a,b-ненасыщен-ные к-ты, их эфиры, амиды, a-галогенолефины) в присут. кислотных катализаторов:
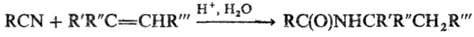
В качестве катализаторов используют 85-100%-ную H2SO4, 90%-ную НСООН, 85-95%-ную Н3РО4, CH3SO2OH, HOSO2X(X = Cl,F), смесь H2SO4 и BF3, борофторид нитро-ния 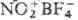 и др. Р-цию вначале проводят при 25-50 °С в орг. р-рителе (напр., в СН3СООН, С2Н5СООН, С4Н9ОС4Н9), в случае жидких нитрилов-без р-рителя. Затем в реакц. среду добавляют воду. Выходы амидов 50-85%.
и др. Р-цию вначале проводят при 25-50 °С в орг. р-рителе (напр., в СН3СООН, С2Н5СООН, С4Н9ОС4Н9), в случае жидких нитрилов-без р-рителя. Затем в реакц. среду добавляют воду. Выходы амидов 50-85%.
Предполагают, что механизм Риттера реакции включает предварит. образование из олефина карбкатиона (ф-ла I), его взаимод. с нуклеоф. атомом N нитрила и послед. гидролиз интер-медиата, напр.:
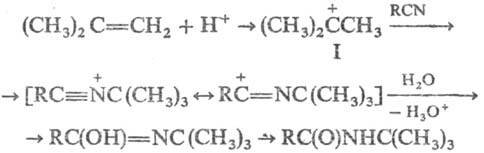
В условиях Риттера реакции карбкатионы образуют также вторичные и третичные спирты, гликоли со вторичными группами ОН и др. Поэтому в широком смысле к Риттера реакции иногда относят р-ции с участием и таких соединений. В-ва, образующие устойчивые карбкатионы (напр., трифенилкарбинол), в р-цию не вступают.
В р-цию, аналогичную Риттера реакции, вступают тиоцианаты, из альдегидов и нитрилов в условиях Риттера реакции образуются бис-амиды:
RSCN + (СН3)3СОН : RSC(O)NHC(CH3)3 2RCN + R'CHO : R'CH(NHCOR)2
В катионах нитрилия, полученных взаимод. нитрилов с гликолями, имеет место самопроизвольное электроф. замыкание цикла, позволяющее с высокими выходами получать разнообразные гетероциклич. соединения (синтез Тильманса-Риттера), напр.:
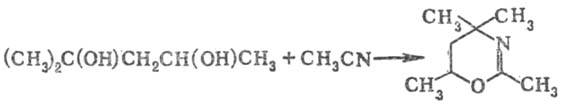
Р-цией динитрилов с гликолями в присут. H2SO4 получают линейные полиамиды.
Риттера реакцию широко используют для лаб. и пром. получения замещенных амидов карбоновых к-т. Р-ция открыта в 1940 П. Графом и подробно изучена в 1948 Дж. Риттером.
Лит.: Зильберман Е.Н., Реакции нитрилов, М., 1972; Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 663-65; Krimen L.I., Cota D. J., в кн.: Organic reactions, v. 17, N.Y., 1969, p. 213-27; Polla E., "Bull. Soc. Chim. Belg.", 1985, v. 94, № 1, p. 81-83. C.K. Смирнов.
