Азиды металлов
АЗИДЫ МЕТАЛЛОВ (пернитриды металлов), соединения, содержащие одну или неск. групп —N3. Известны: простые азиды M(N3)n (n-степень окисления металла М), представляющие собой соли азотистоводородной к-ты HN3; двойные, в к-рых группы —N3 соединены с атомами двух или более металлов [напр., K2Cd(N3)4]; смешанные, содержащие, помимо группы —N3, др. анион [напр., Zn(N3)Cl]; комплексные, в к-рых азидная группа входит во внутр. координац. сферу металла (напр., [Mn(N3)4]OR). Относительно хорошо изучены только азиды щелочных и щел.-зем. металлов, Ag, Tl, Cu, Pb и нек-рых других.
Группа —N3 линейна (см. Азиды органические). Тип связи М—N3 преим. ионный; степень ионности возрастает при переходе от тяжелых металлов (Pb, Ag, Tl) к 3d-металлам и далее к щел.-зем. и щелочным.
СВОЙСТВА АЗИДОВ МЕТАЛЛОВ
| Азид | Кристаллич. решетка | Пространств. группа | Т. пл., °С | Р-римость, г в 100 г воды | 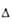 H0обр. кДж/моль H0обр. кДж/моль |
| LiN3 | Гексаген. | R Зт | 813 | 66,41 (18 °С) | 7,3 |
| NaN3 | Гексаген.* | R3m | — | 28,0 (0-С) | 21,3 |
| KN3 | Тетрагон. | 14/тст | 354- | 107,1 (16°С) | -1,7 |
| RbN3 | Тетрагон. | 14/тст | 321 | — | 4,2 |
| CsN3 | Тетрагон. | 14/тст | 326 | 224,2 (0°С) | -19,6 |
| Ca(N3)2 | Ромбич. | Fddd | 140-160** | 45,0 (15°С) | 14,2 |
| Sr(N3)2 | Ромбич. | Fddd | — | 45,83 (15°С) | 2,5 |
| Ba(N3)2 | Моноклинная | njm | 220** | 17,0 (17°С) | 22,2 |
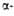 Pb(N3)2 Pb(N3)2 | Ромбич. | Рnmа | 350** | 0,023 (18°С) | 482,0 |
* Параметры решетки: а = 0,3646 нм, с = 1,5214 нм. Число формульных единиц в ячейке 2 = 3. ** Т-ра разложения (со взрывом).
Азиды металлов - кристаллы (см. табл.). Они неустойчивы: во мн. случаях при трении, ударе, нагревании, действии света разлагаются со взрывом (иногда взрыв происходит даже при использовании влажного азидв металлов или его р-ра). Только азиды щелочных металлов (кроме Li) могут разлагаться при нагр. без взрыва.
Азиды тяжелых металлов плохо раств. в воде, азиды щелочных металлов - хорошо и в р-ре проявляют св-ва, характерные для солей слабых одноосновных к-т. При действии на азиды металлов окислителей они разлагаются, напр.: NaN3+ NOC1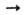 NaCl + N2O + N2. Водород восстанавливает азиды металлов в присутствии катализаторов (Pt, амальгама А1) до амидов металлов и N2 или до свободного металла, NH3 и N2.
NaCl + N2O + N2. Водород восстанавливает азиды металлов в присутствии катализаторов (Pt, амальгама А1) до амидов металлов и N2 или до свободного металла, NH3 и N2.
Исходное соед. для синтеза всех азидов металлов - азид натрия, к-рый получают действием N2O на расплав NaNH2 при 200°С: 2NaNH2 + N2O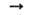 NaN3 + NaOH + NH3. Он м. б. синтезирован также взаимод. NaNO3 с NaNH2 или Na2O со смесью газообразных N2O и NH3. Другие азиды металлов обычно получают обменной р-цией солей металла с NaN3 в водном р-ре.
NaN3 + NaOH + NH3. Он м. б. синтезирован также взаимод. NaNO3 с NaNH2 или Na2O со смесью газообразных N2O и NH3. Другие азиды металлов обычно получают обменной р-цией солей металла с NaN3 в водном р-ре.
Анализируют азиды металлов окислением группы —N3 иодом в водном р-ре (2N-3 + 12 + 2Н+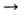 2HI +_ 3N2) с послед. определением объема выделяющегося N-2. Они м. б. определены также путем осаждения N3 в виде AgN3 или отгонкой газообразной HN3, образующейся при действии к-т на р-ры азидов, с послед. поглощением HN3 р-ром КОН.
2HI +_ 3N2) с послед. определением объема выделяющегося N-2. Они м. б. определены также путем осаждения N3 в виде AgN3 или отгонкой газообразной HN3, образующейся при действии к-т на р-ры азидов, с послед. поглощением HN3 р-ром КОН.
Азиды тяжелых металлов, из к-рых наиб. важен свинца азид,- инициирующие ВВ. Азид Na используют для получения орг. и неорг. азидов, особо чистого азота, как порообразователъ. Нек-рые азиды [напр., CsN3, Ba(N3)2, Sr(N3)2]-промежут. соед. при получении особо чистых металлов.
Литература
БагалЛ.И., Химия и технология инициирующих взрывчатых веществ, М., 1975; Energetic materials, v. 1-2, N.Y., 1977. П.М. Ч у куров.
