Азиды органические
АЗИДЫ ОРГАНИЧЕСКИЕ, производные азотистоводородной к-ты HN3, в к-рой атом Н замещен на орг. радикал. Азидогруппа —N3 м. б. связана с атомом С, напр, в алкил- и арилазидах (диазоиминосоединениях) RN3, ацилазидах (диазоимидах) RC(O)N3, или с гетероатомом, напр. в азидах арилсулъфокислот. Азиды могут содержать неск. азидогрупп в молекуле.
Названия азидрв образуют, прибавляя к названию радикала окончание "азид", напр. СН3Ы3-метилазид, С6Н5С(О)N3-бензоилазид, или ставя перед названием соединения, радикал к-рого входит в азид, приставку "азидо", напр. С6Н5Н3-азидобензол, НС(О)СН2N3-азидоацетальдегид.
Многие азиды (особенно содержащие более 25% азидного азота) легко разлагаются; при сильном нагревании или ударе взрываются. Азиды раств. в орг. р-рителях, плохо - в воде.
Азидогруппа линейна. Ее конфигурация на примере CH3N3 приведена ниже: 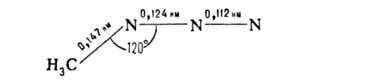
Строение группы —N3 промежуточное между тремя предельными структурами с преобладающим вкладом первых двух: 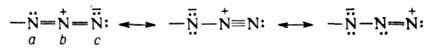
Атом Nb имеет гибридизацию sp, Na-sp2, Nc — spx (1 < x < 2).
В алифатич. соед. группа —N3 проявляет отрицат. индукционный эффект. С ароматич. кольцом может вступать в р,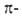 или
или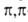 -сопряжение, проявляя соотв. положит. или сла-боотрицат. мезомерный эффект; константы Гаммета
-сопряжение, проявляя соотв. положит. или сла-боотрицат. мезомерный эффект; константы Гаммета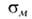 0,37,
0,37,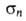 -0,08,
-0,08,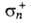 -0,54,
-0,54,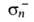 -0,11. Основные св-ва проявляет атом Na.
-0,11. Основные св-ва проявляет атом Na.
В ИК-спектрах арил- и алкилазидов проявляются асимметричные и симметричные валентные колебания в областях 2135-2090 и 1300-1270 см -1. В УФ-спектрах алифатич. азидов имеются два максимума, напр. для C4H9N3 при 285 и 215.нм (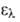 25 и 500 соотв.).
25 и 500 соотв.).
При наличии в молекуле азида ацильной, эфирной или сульфонильной группы, сопряженной с азидогруппой, степень двоесвязанности связи N—N2 понижается, облегчая ее разрыв:
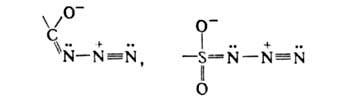
Такие азиды менее стабильны, т-ры разложения их ниже, а реакционная способность выше, чем у алкил- и арилазидов. Термич. и фотохим. разложение азидов сопровождается выделением N2 (промежуточно образуются нитрены), напр.:
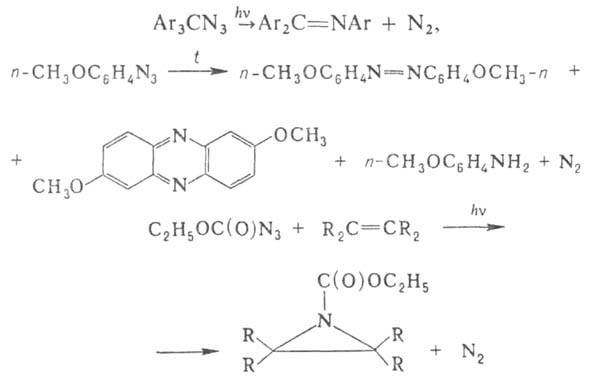
Отщепление N2 от ацилазидов при 20-150 °С в средах от нейтральной до сильнокислой сопровождается внутримол. перегруппировкой с образованием изоцианатов, к-рые мгновенно взаимод. с р-рителем, напр. со спиртом образуют уретаны (см. Курциуса реакция].
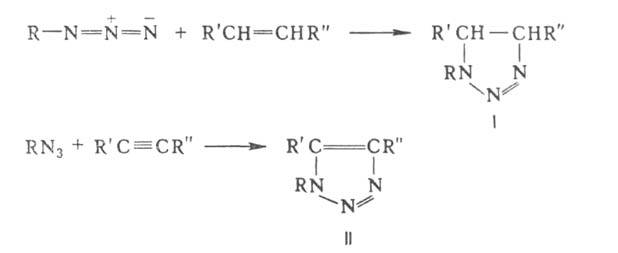
В результате 1,3-диполярного циклоприсоединения азидов к ненасыщенным соед. (диполярофилам) при т-рах ниже т-ры разложения азидов образуются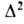 -1,2,3-триазолины (ф-ла I) и 1,2,3-триазолы (II), напр.:
-1,2,3-триазолины (ф-ла I) и 1,2,3-триазолы (II), напр.:
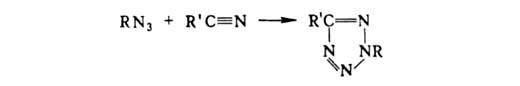
Циклоприсоединение азидов к нитрилам приводит к тетразолам:
Алкил- и арилазиды при взаимод. с реактивом Гриньяра превращаются в диазоаминосоединения: 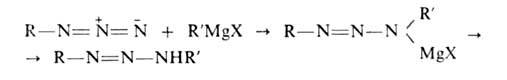
Ацилазиды гидролизуются разб. водными р-рами к-т или оснований до карбоновых к-т и HN3.
Азиды получают действием NaN3 на алифатич. и ароматич. галогенсодержащие соед. [RHal, RSO2Hal, RC(O)Hal], напр.: RHal + NaN3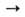 RN3 + NaHal. Арилазиды синтезируют также по р-ции:
RN3 + NaHal. Арилазиды синтезируют также по р-ции:
[ArN=N] + Hal- + NaN3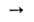 ArN3 + N2 + NaHal
ArN3 + N2 + NaHal
Нитрозирование арилгидразинов или гидразидов карбоновых к-т приводит соотв. к арил- или ацилазидам, напр.:
ArNH—NH2 + HONO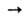 ArN3 + H2O. Азидоформиаты получают при 0°С в среде хлороформа:
ArN3 + H2O. Азидоформиаты получают при 0°С в среде хлороформа:
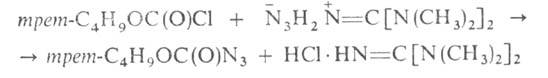
Количеств. определение азидогруппы в арил- и алкилазидах основано на восстановлении ее арсенат-иоыами до аминогруппы и иодометрич. титровании образовавшихся арсенит-ионов; в ацилазидах - на газометрич. определении N2, выделившегося при перегруппировке Курциуса. Колориметрически и фотометрически азиды определяют по интенсивно красному окрашиванию с солями Fe(III).
Азиды используют для стерилизации масел (напр., бензил-азид, толилазид), как ацилирующие агенты аминокислот, в синтезе полипептидов, аминов (см. Шмидта реакция) и многих азотсодержащих ароматич. и гетероциклич. соединений. 2-Азидо-4-метилтио-6-изопропиламино-сим-триазин (азипротрин)-гербицид.
Литература
Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 313-25; L'Abbe G., "Chem. Revs.", 1969, v. 69, №3, p. 345-63; Hedayatullah M., Hugueny J., "Synth. Commun.", 1981, v. 11, № 8, p. 643-46. P. Я. Попова.
