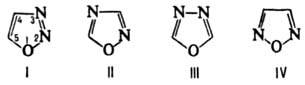
Оксадиазолы
ОКСАДИАЗОЛЫ, мол. м. 70,06. Различают 1,2,3-, 1,2,4-, 1,3,4- и 1,2,5-оксадиазолы (ф-лы соотв. I-IV). Оксадиазолы-бесцв. жидкости или кристаллы (см. табл.). Известны замещенные 1,2,3-оксадиазолы, имеющие структуру сид-нонов и сиднониминов (см. Мезоионные соединения).
Незамещенный 1,2,4-оксадиазол -неустойчивая жидкость, 3-метил-производное стабильно при 0°С, 5-фенилпроизводное - при 20 °С. 3,5-Дизамещенные производные устойчивы к нагреванию, инертны к действию конц. H2SO4 и дымящей HNO3. Замещенные 1,2,4-оксадиазолы не вступают в электроф. замещение по атомам С цикла. Нуклеоф. замещение легче всего протекает в положение 5; напр., атом хлора в 5-хлор-3-алкил(арил)-1,2,4-оксадиазолах легко замещается на амино-, гидрокси- и алкокси-группы.
Под действием к-т, щелочей или восстановителей происходит раскрытие цикла, напр.:
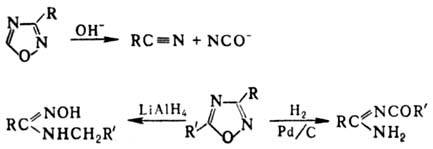
3-Винил- и 5-винил-3-фенил-1,2,4-оксадиазолы легко полимеризуются; используются для получения синтетич. волокон (см. Термостойкие волокна).
СВОЙСТВА НЕКОТОРЫХ ОКСАДИАЗОЛОВ
| Соединение | Мол. м. | Т. пл., °С | Т. кип., °С |
| 1 ,2,4-Оксадиазолы | | ||
| 5-Метил-З-фенил- 1 ,2,4-оксадиазол | 160,17 | 41-42 | _ |
| 3-Метил-5-фенил-1,2,4-оксадиазол | 160,17 | 55-56 | - |
| 3,5- Дифенил-1 ,2,4-оксадиазол | 222,25 | 108 | 210/17 мм рт.ст. |
| 1 ,3,4-Оксадиазолы | . | ||
| 1,3,4-Оксадиазол | 70,06 | _ | 150-151 |
| 2,5-Диметил-1 ,3,4-оксадиазол | 98,1 | _ | 178-179 |
| 2-Метил-5-фенил- 1 ,3,4-оксадиазол | 160,17 | 61-64 | _ |
| 2,5- Дифенил-1 ,3,4-оксадиазол | 222,25 | 138-140 | 231/13 мм рт.ст. |
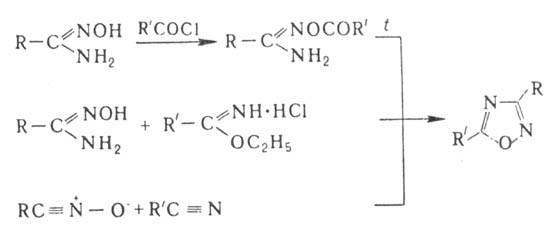
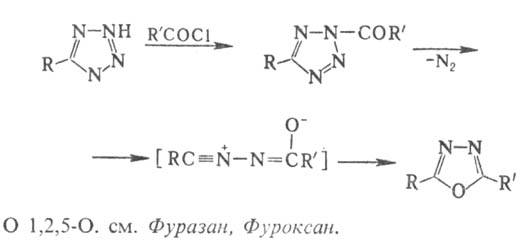
Осн. методы синтеза производных 1,2,4-оксадиазола- пиролиз О-ациламидоксимов, конденсация амидоксимов с гидрохлоридами иминоэфиров, р-ции 1,3-диполярного циклоприсое-динения N-оксидов нитрилов с нитрилами:
1,3,4-Оксадиазол и его производные хорошо раств. в большинстве орг. р-рителей (низшие 2-алкил- и 2,5-диалкил-1,3,4-оксадиазолы раств. в воде); образуют комплексные соед. с AgNO3 и HgCl2; мн. производные 1,3,4-оксадиазола обладают высокой термич. стабильностью.
Для 1,3,4-оксадиазола и его монозамещенных р-ции электроф. замещения (нитрование, сульфирование) не характерны, галогенирование протекает с трудом; 2,5-диарил-1,3,4-оксадиазолы с галогенами образуют комплексы. Действие нуклеоф. реагентов на производные 1,3,4-оксадиазола обычно приводит к расщеплению цикла или к образованию др. гетероцикла. Аналогично протекает кислотный или щелочной гидролиз:
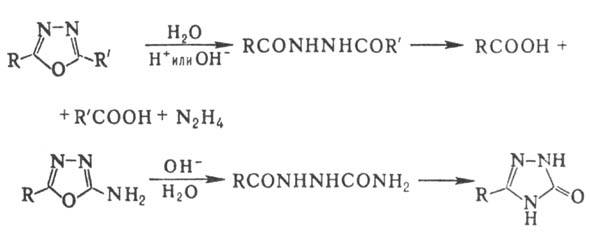
По легкости кислотного гидролиза замещенные 1,3,4-оксадиазолы располагаются в ряд: 2-алкил-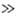 2-арил- > 2-алкокси-5-арил- > > 2,5-диалкил- > 2-алкил-5-арил
2-арил- > 2-алкокси-5-арил- > > 2,5-диалкил- > 2-алкил-5-арил 2,5-диарил. 2,5-Диалкил-, 2-алкил-5-арил- и 2,5-диариллроизводные при нагр. с форм-амидом (170-180 °С) или с первичными ариламинами (240-280 °С) образуют производные 1,2,4-триазола:
2,5-диарил. 2,5-Диалкил-, 2-алкил-5-арил- и 2,5-диариллроизводные при нагр. с форм-амидом (170-180 °С) или с первичными ариламинами (240-280 °С) образуют производные 1,2,4-триазола:
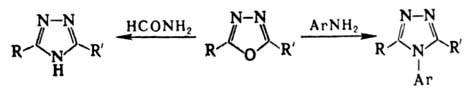
Метод получения незамещенного 1,3,4-оксадиазола и его 2-замещенных - нагревание N-ацилгидразинов с ортомуравьиным эфиром:
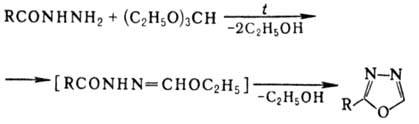
Симметричные 2,5-диалкил-1,3,4-оксадиазолы получают взаимод. кар-боновых к-т с N2H4·2HCl в присут. РОСl3. Др. методы получения 2,5-дизамещенных 1,3,4-оксадиазолов-внутримол. циклизация N,N'-диацилгидразинов (дегидратирующие агенты РОСl3, SOCl2, P2O5, конц. H2SO4) и конденсация N-ацил-гидразинов с гидрохлоридами иминоэфиров:
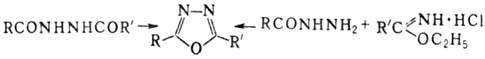
Производные 1,3,4-оксадиазола м.б. синтезированы также и из др. гетероциклич. систем по р-циям рсциклизации, напр.:
Многие 1,2,3-, 1,2,4-, 1,3,4-оксадиазолы и их производные обладают противовоспалит., антибактериальной, анальгетич., противотуберкулезной и противомалярийной активностью, являются эффективными фунгицидами, инсектицидами и антидепрессантами (сиднофен, сиднокарб). Производные 1,3,4-оксадиазола применяют при получении термостойких полимерных материалов (напр., линейных и циклич. полиоксадиазолов). 2,5-бис-(Перфторалкил)-1,3,4-оксадиазолы используют в произ-ве р-ри-телей для фторир. полимеров и фотоматериалов (напр., фотографич. эмульсий) с повыш. термич. стабильностью. Производные 2,5-диарил-1,3,4-оксадиазолов-сцинцилляторы [напр., 2-фенил-5-(4-бифенилил)- и 2-(4-бифенилил)-5-(1-нафтил)-1,3,4-оксадиазолы], люминофоры, красители, фотохромные препараты.
Лит.: Насыпов Е. П., Греков А. П., "Успехи химии", 1964, т. 33, в. 10, с. 1184-97; Гетероциклические соединения, под ред. Р. Эльдерфилда, пер. с англ., т. 7, М., 1965; Nonbenzenoid aromatics, ed. by J.P. Snyder, v. 1, N.Y., 1969, p. 117-248; Clapp L. В., "Adv. Heterocyclic Chem.", 1976, v. 20, p. 65-116; Ol-lis W.D., Ramsden С. А., там же, 1976, v. 19, p. 1-123.
P. А. Караханов, В. И. Келарев.
