Газовые гидраты
ГАЗОВЫЕ ГИДРАТЫ, клатраты, в к-рых "гостями" являются молекулы газов или легкокипящих жидкостей (О2, N2, Аг, Хе, Вr2, С12, SF6, H2S, CH4, C3H8, СНС13 и др.), а "хозяевами" - молекулы воды, образующие кри-сталлич. каркас. По внеш. виду напоминают снег или рыхлый лед, но в отличие от них могут существовать при положит. т-рах.Молекулы газа размещены в полостях кристаллич. решетки из молекул воды и удерживаются в них ван-дер-ваальсовыми силами. Полости имеют вид многогранников (см. рис.). Кристаллич. решетка из молекул воды, характерная для газовых гидратов, если она не заполнена строго определенным кол-вом молекул газа, термодинамически нестабильна. Газовые гидраты в осн. кристаллизуются в одной из двух сингоний: объемно-центрированной кубической типа CsCl (структура I; a = = 1,2 нм, z = 46, пространств. группа РтЗт)и гранецентри-рованной кубической типа алмаза (структура II; а = = 1,73-1,74 нм, z=136, пространств. группа Fd3m). В элементарных ячейках имеются полости: в структуре 1-6 больших (диам. 0,59 нм) и 2 малых (0,52 нм), в структуре II-8 больших (диам. 0,69 нм) и 16 малых (0,48 нм).
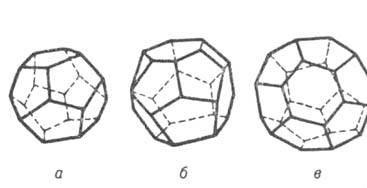
Оищий вид больших и малых полостей в кристаллич. решетках Гл.: a-малая полость структур I и II, б, в-большие полости структур I и II соответственно.
Гидраты образуются газами, макс. диаметр (dмакс) молекул к-рых менее 0,69 нм. Если dмакс больше 0,52 нм, но меньше 0,59 нм (Вг2, CH3SH, COS и др.), заполняются только большие полости кристаллич. решетки I. При полном заполнении всех полостей число молекул воды (n), приходящееся на одну молекулу "гостя", составляет 7,66. Если dмакс меньше 0,52 (Ar, CH4, H2S и др.), наряду с большими будут заполняться и малые полости; при полном заполнении всех полостей и составляет 5,75. Гидраты с кристаллич. структурой II образуются газами, dмакс молекул к-рых меньше 0,69 нм, но больше 0,59 нм (С3Н8, изо-С4Н10, СНС13 и др.); при этом заполняются большие полости (п = = 17). Если газовый гидрат образован двумя газами (двойной газовый гидрат), для одного из к-рых dмакс меньше 0,48 нм, а для другого dмакс больше 0,59 нм, заполняются и малые, и большие полости (п = 5,67).
Плотность газовых гидратов составляет 0,8-1,24 г/см3, напр. плотность С3Н8-17Н2О-0,88 г/см3. Для газовых гидратов с n = 6 величина H°обр лежит в пределах от — 58,6 до — 71,1 кДж/моль, с п
H°обр лежит в пределах от — 58,6 до — 71,1 кДж/моль, с п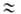 9 от - 79,5 до - 83,7 кДж/моль, с п
9 от - 79,5 до - 83,7 кДж/моль, с п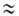 17 от - 121,3 до - 133,9 кДж/моль. Газовые гидраты структуры I не имеют критич. т-ры, структуры II имеют. Так, для гидрата С3Н8 tкрит 278,8 К при 552 кПа, BrClF2C 283,1 К при 169 кПа, СН3С1 293,6 К при 496,0 кПа. С увеличением размера молекулы газа или жидкости, образующей гидрат, т-ра диссоциации газовых гидратов при одном и том же давлении повышается. Так, при давл. 101,3 кПа для гидрата СН4 эта т-ра 194,4 К, С2Н6 241,6 К, С3Н8 261,5 К.
17 от - 121,3 до - 133,9 кДж/моль. Газовые гидраты структуры I не имеют критич. т-ры, структуры II имеют. Так, для гидрата С3Н8 tкрит 278,8 К при 552 кПа, BrClF2C 283,1 К при 169 кПа, СН3С1 293,6 К при 496,0 кПа. С увеличением размера молекулы газа или жидкости, образующей гидрат, т-ра диссоциации газовых гидратов при одном и том же давлении повышается. Так, при давл. 101,3 кПа для гидрата СН4 эта т-ра 194,4 К, С2Н6 241,6 К, С3Н8 261,5 К.
Многие технол. процессы в хим., газовой и нефтехим. пром-сти сопровождаются образованием газовых гидратов, что может приводить, напр., к закупорке трубопроводов и аппаратов и в результате к авариям. Для предотвращения образования газовых гидратов в газовый поток вводят ингибиторы (р-ры солей, напр. NaCl, СаС12, спирты, гликоли и др.), к-рые частично связывают воду и увеличивают давление гидратообразования при данной т-ре или снижают т-ру гидратообразования при данном давлении. При добыче прир. газа в кач-ве ингибиторов чаще всего используют метанол или р-р СаС12, на заводах синтетич. спирта-метанол или изопропанол, к-рые вводят в дефлегматор ректификац. колонны. Для предотвращения гидратообразования применяют также осушку газов.
Образование газовых гидратов используют при опреснении морской воды, хранении газов в виде гидратов, разделении многокомпонентных газовых и жидких смесей, при транспорте прир. газа в виде гидратной пульпы, для ликвидации туманов.
Газовые гидраты углеводородов широко распространены в природе, они залегают в разрезах осадочных пород на материках и дне океанов. Запасы прир. газа в виде газовых гидратов, вероятно, значительно превышают запасы газа в своб. состоянии.
Впервые газовый гидрат (хлора) получил Г. Дэви в 1811.
Литература
Нестехиометрические соединения, под ред. Л. Манделькорна, пер. с англ., М., 1971, с. 607; Макогон Ю.Ф., Гидраты природных газов, М., 1974; Бык С.Ш., Макогон Ю.Ф., Фомина В.И., Газовые гидраты, М., 1980; Макогон Ю.Ф., Газовые гидраты, предупреждение их образования и использование, М., 1985. , В. И. Фомина.
