Гетеролитические реакции
ГЕТЕРОЛИТИЧЕСКИЕ РЕАКЦИИ (от греч. heteros-иной, другой и lysis-разложение, распад), протекают с гетеролизом хим. связи, т.е. с таким ее разрывом, при к-ром электронная пара, осуществляющая связь, остается у одного из атомов и, как правило, образуются ионы: 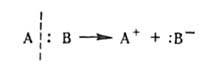
Иногда к гетеролитическим относят также р-ции, в к-рых образование новой химической связи происходит в результате обобществления электронной пары одного из реагентов.
Осуществлению гетеролитических реакций благоприятствует использование в кач-ве реагентов сильных к-т или оснований, высокая диэлектрич. проницаемость среды. Гетеролиз энергетически менее выгоден (на 300-650 кДж/моль), чем гомолиз (см. Гомолитические реакции), однако в р-рах благодаря сольватации образующихся ионов гетеролитические реакции протекают сравнительно легко.
В орг. химии гетеролитические реакции принято делить в зависимости от характера разрыва связи С—X на нуклеофильные реакции (заместитель X уходит с электронной парой и образуется карбкатион) и электрофильные реакции (электронная пара остается у атома С и образуется карбанион). Механизм гетеролитических реакций иногда может включать промежут. образование ионрадикалов, в этом случае говорят о наличии стадии одно-электронного переноса.
Типичные гетеролитические реакции-распад молекул на ионы, рекомбинация ионов, мн. процессы замещения, элиминирования и присоединения, в т.ч. такие промышленно важные, как нитрование и сульфироваиие ароматич. соединений, присоединение галогенов к олефинам в полярных р-рителях.
Литература
Беккер Г., Введение в электронную теорию органических реакций, пер. с нем., М., 1977.
