§ 4. Подгруппа галлия
Содержание каждого из членов данной подгруппы в земной коре по ряду галлий (4·10–4%)–индий (2·10–6%) –таллий (8·10–7%) уменьшается. Все три элемента чрезвычайно распылены и богатые ими минералы неизвестны. Напротив, незначительные примеси их соединений содержат руды многих металлов, в частности Zn. Получают Ga, In и Тl из отходов при переработке подобных руд.
В свободном состоянии галлий, индий и таллий представляют собой легкоплавкие серебристо–белые металлы. Их важнейшие константы сопоставлены ниже:
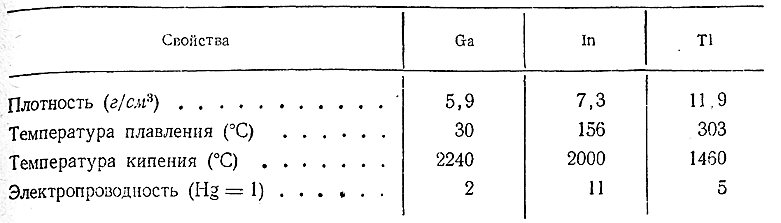
По твердости галлий близок к свинцу, In и Тl – еще мягче.
На воздухе/галлий не изменяется, а индий и таллий медленно окисляются с поверхности. При накаливании все три элемента энергично соединяются с кислородом и серой. С хлором и бромом они взаимодействуют уже при обычной температуре, с иодом – лишь при нагревании. Располагаясь в ряду напряжений около железа, Ga, In и Тl растворимы в кислотах.
Обычная валентность галлия и индия равна трем. Таллий дает производные, в которых он трех– и одновалентен.
Окиси галлия и его аналогов – белая Ga2 O3 , желтая In2 О3 и коричневая Тl2 О3 –в воде нерастворимы. Отвечающие им гидроокиси Э(ОН)3 (которые могут быть получены из солей) представляют собой студенистые осадки, практически нерастворимые в воде, но легко растворяющиеся в кислотах. Белые гидроокиси Ga и In растворимы также в растворах сильных щелочей с образованием аналогичных алюминатам галлатов и индатов. Они имеют, следовательно, амфотерный характер, причем кислотные свойства выражены у In(ОН)3 слабее, а у Ga(OH)3 сильнее, чем у Аl(ОН)3 . Так, помимо сильных щелочей, Ga(OH)3 растворима в крепких растворах NH4 OH. Напротив, красно–коричневая Т1(ОН)3 в щелочах почти не растворяется.
Ионы Ga3+и In3+бесцветны, ион Тl3+ слабо окрашен в желтоватый цвет. Производящиеся от них соли большинства кислот хорошо растворимы в воде, но сильно гидролизованы.
В то время как производные низших валентностей Ga и In для них не типичны, для таллия наиболее характерны именно те соединения, в которых он одновалентен. Поэтому соли Тl3+ имеют заметно выраженные окислительные свойства.
Закись таллия (Тl2 О) образуется в результате взаимодействия элементов при высоких температурах. Она представляет собой черный гигроскопичный порошок. С водой закись таллия образует желтый гидрат закиси (ТlOН), который при нагревании легко отщепляет воду и переходит обратно в Тl2 О.
Гидрат закиси таллия хорошо растворим в воде и является сильным основанием. Образуемые им соли в большинстве бесцветны я кристаллизуются без воды. Хлорид, бромид и иодид почти нерастворимы, а многие другие соли растворимы хорошо. Производные ТlOН и слабых кислот вследствие гидролиза дают в растворе щелочную реакцию. При действии сильных окислителей одновалентный таллий окисляется до трехвалентного.
По свойствам элементов и их соединений подгруппа галлия во многом похожа на подгруппу германия. Так, для Ge и Ga более устойчива высшая валентность, для Pb и Тl низшая; химический характер гидроокисей в рядах Ge–Sn–Pb и Ga–In–Ti изменяется однотипно и т. д. Иногда проявляются даже более тонкие черты сходства, например малая растворимость галоидных (О, Br, J) солей как Pb, так и Тl. При всем том между элементами обеих подгрупп имеются и существенные различия (частично обусловленные их разной валентностью). Например, кислотный характер гидроокисей Ga и его аналогов выражен значительно слабее, чем у соответствующих элементов подгруппы германия, в противоположность PbF2 фтористый таллий легко растворим и т. д.


