§ 6. Семейство лантанидов
Как уже отмечалось в предыдущем параграфе, непосредственно к лантану примыкает 14 родственных Друг другу элементов, объединяемых под названием семейства лантанидов. Членами последнего являются:
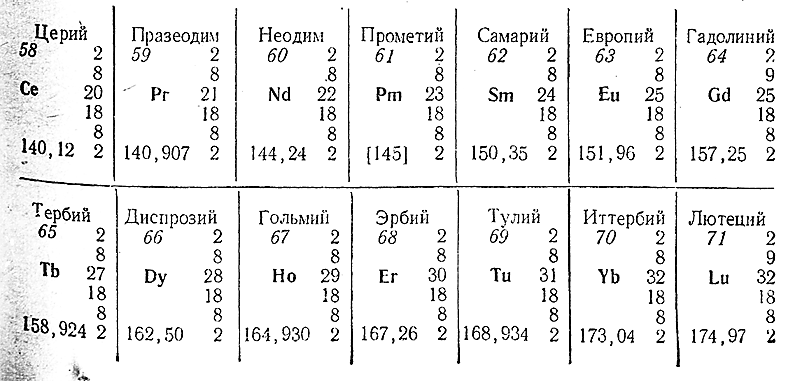
Как видно из данных таблицы, два внешних электронных слоя в атомах почти всех лантанидов построены одинаково, а изменение претерпевает третий слой, число электронов которого при переходе от La к Lu возрастает с 18 до 32. Так как химические свойства элементов связаны со структурой главным образом внешних электронных слоев, изменение числа электронов в третьем отражается на них довольно слабо. В связи с этим все лантаниды по свойствам похожи друг на друга и являются как бы членами «гомологического ряда» лантана.
Б природе лантаниды очень рассеяны и встречаются всегда смешанными друг с другом, лантаном и иттрием. Их относительное содержание в земной коре показано на рис. 165 (за единицу принято содержание церия – 0,0005%). Как видно из рисунка, лантаниды с нечетными положительными зарядами ядер менее распространены в природе, чем их ближайшие соседи с четными. Несмотря на то, что содержание почти всех лантанидов в земной коре больше, чем таких «обычных» элементов, как, например, J и Hg, их практическое использование еще очень мало. Одной из причин этого является трудность отделения рассматриваемых элементов друг от друга ввиду чрезвычайного сходства их свойств.

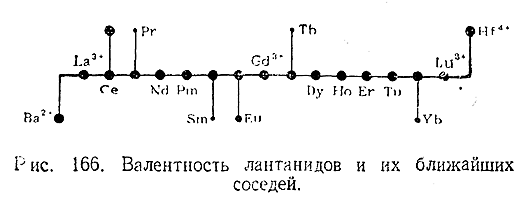
Все лантаниды, как правило, трехвалентны. Церий, кроме того, дает ряд производных, в которых он четырехвалентен. Известны также окислы четырехвалентных Рr и Тb и некоторые соли двухвалентных Sm, Eu и Yb. Однако соединения эти значительно менее характерны для рассматриваемых элементов, чем те производные, в которых они трехвалентны. Валентности лантанидов и их ближайших соседей по шестому периоду наглядно сопоставлены на рис. 166 (относительные размеры точек дают оценку характерности того или иного валентного состояния для данного элемента).
В более или менее чистом виде выделены были только Се, Рr, Nd, Sm и Еu. По свойствам они близки к лантану (тогда как остальные лантаниды более похожи на иттрий).
Окислы лантанидов представляют собой тугоплавкие порошки, нерастворимые в воде, но энергично присоединяющие ее с образованием гидратов окисей. Окислы Се, Gd, Yb и Lu бесцветны, а остальные имеют цветные оттенки: Еu, Тb и Еr – розовый, Sm, Dy и Но – желтый, Рr и Тu – зеленый, Nd – голубой.
Гидроокиси Э(ОН)3 в воде почти нерастворимы. Все они имеют только основной характер. По степени его выраженности гидроокиси лантанидов можно расположить в ряд, совпадающий с рядом ионных радиусов тех же элементов:

Положение Y(OH)3 в этом ряду – между гидроокисями Dy и Но – также соответствует значению радиуса Y3+(1,06 А). С точки зрения рассматривавшихся ранее представлений (V § 5) подобная зависимость свойств Э(ОН)3 от радиусов ионов Э3+ вполне понятна. В соответствии со своим основным характером гидроокиси лантанидов нерастворимы в щелочах, но легко реагируют с кислотами.
Соли лантанидов очень похожи по свойствам на соответствующие соли La и Y. Окраска ионов Э3+ обычно такова же, как у окислов (исключение – розовый Nd3+). Для производных прометия характерны цвета розовый [Pm(NО3 )3 ] и желтый (РmСl3 ). Применение находит главным образом Се(NО3 )3 (в производстве сеток для керосинокалильных ламп).
Важным отличием церия от остальных лантанидов является устойчивость его высшего окисла и некоторых производных последнего. Бледно–желтая двуокись церия (СеО2 ) образуется при накаливании на воздухе как самого металла, так и его солей. Отвечающий ей гидрат – Се(ОН)4 – представляет собой желтый студенистый осадок. Его основные свойства выражены слабее, чем у Sc(OH)3 . В щелочах Се(ОН)4 почти нерастворим, а в кислотах растворяется, образуя соответствующие соли.
Ион Се4+ имеет оранжевую окраску. Соли четырехвалентного Церия в растворе сильно гидролизованы. Если в щелочной среде трехвалентный церий легко окисляется до четырехвалентного (уже кислородом воздуха), то в кислой производные чеытрехвалентного церия малоустойчивы и являются сильными окислителями. Взаимодействие Се(ОН)4 со способными окисляться кислотами (например, НСl) ведет к образованию солей трехвалентного церия. В связи с этим число известных производных четырехвалентного церия весьма ограничено.
Хотя четырехвалентность церия в некоторых его соединениях и создает этому элементу несколько особое положение среди Других лантанидов, однако в целом последние проявляют исключительно близкое сходство с основными элементами подгруппы скандия, весьма закономерно укладываясь по большинству свойств между лантаном и скандием.


